AAV在脑组织中的靶向策略(干货篇)
神经系统分为中枢神经系统(Central nervous system, CNS)和外周神经系统(Peripheral nervous system,PNS)。中枢神经系统包括脑和脊髓,分别位于颅腔和椎管内,是神经系统的主要部分,外周神经系统包括与脑相连的脑神经(cranial nerves)和与脊髓相连的脊神经(spinal nerves)。随着研究的深入,人们对神经系统功能已经有了更近一步的认识,但由于神经系统的复杂性、组织再生能力的有限性以及血脑屏障对药物传送的阻隔,使用传统药物和外科手术方法治疗神经系统类疾病仍困难重重。
人脑解剖图
目前,基因疗法已被应用于多种疾病的治疗,利用病毒载体将遗传物质传递到器官周围,并在靶细胞中实现特异表达,进而实现基因治疗。在神经科学研究中,尤其是在体实验,通常利用腺相关病毒工具载体研究基因的功能作用,那么如何才能更高效地利用AAV在神经系统进行基因转导呢?今天我们就一起学习AAV在神经研究中的选择策略。
一、AAV血清型的选择
据报道,目前适用于神经系统的AAV血清型有:1、2、5、6、8、9、PHP.B、PHP.eB、PHP.S、DJ、Retro、rh10等十几种,不同的血清型在神经系统不同部位的感染效率及扩散能力不同,合适的血清型关乎基因是否能够实现高效稳定表达,甚至关乎最终的研究结果,因此综合标记的细胞和每种AAV血清型的特性等因素来选择合适的AAV血清型至关重要。根据文献报道,AAV1,2和5在CNS转导水平有限,且表现出不同的细胞特异性,如AAV1和5能转导神经元和胶质细胞,而AAV2只能转导神经元。AAV9在CNS中的应用则较为广泛,具有强的扩散性,且能穿过血脑屏障(BBB)实现基因高表达。而在外周神经系统中,AAV9、rh10、PHP.S的感染效果较好。
接下来,就来详细介绍一下在神经环路示踪中几种常用的AAV血清型:
1、可逆向示踪的血清型— AAV2-retro
常见的AAV病毒载体都是顺向标记,极少能进行逆行传递,这大大限制了AAV载体在神经环路示踪中的应用。直到2016年,研究人员在AAV2的基础上,通过定向进化的方式改造出一种具有逆向示踪功能的AAV2突变体——AAV2-retro,该载体能够在小鼠大脑中进行有效的神经环路逆向标记,且其逆行示踪能力和效率与传统的逆行示踪剂相当。图2所示为rAAV2-retro的开发过程及应用实例:
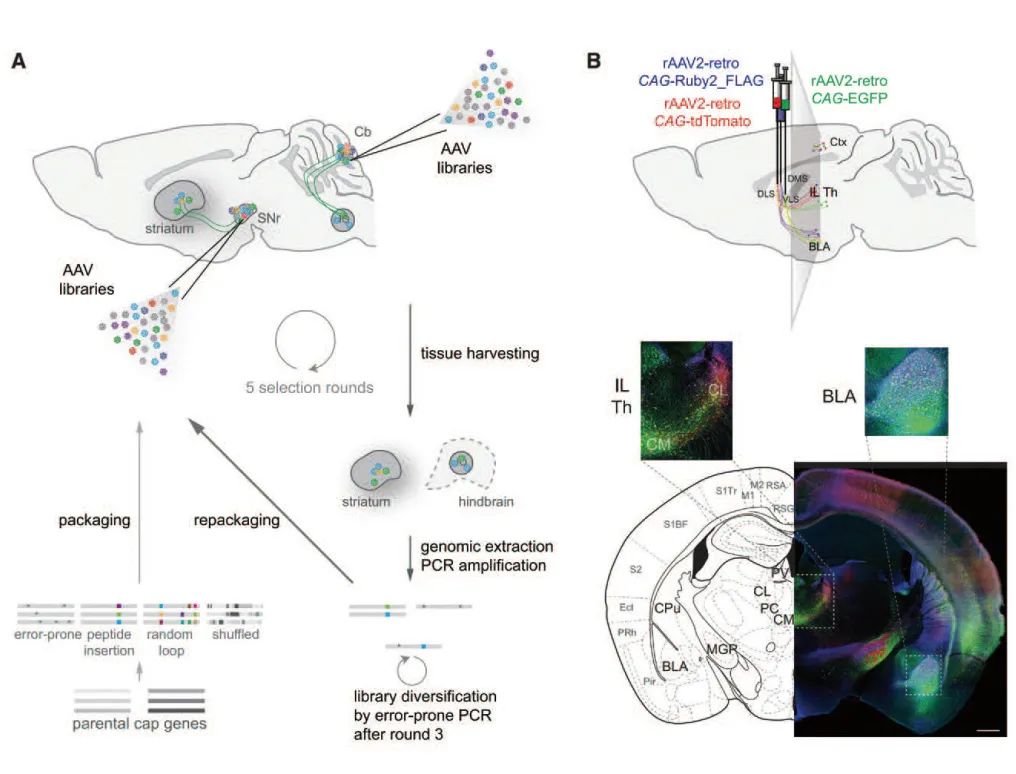
rAAV2-retro(逆向非跨突触标记)
(Tervo et al., Neuron, 2016)
2、可顺向跨单级突触的血清型 — AAV1
2017年张砺教授团队研究报道AAV1能在高滴度条件下呈顺向跨突触传播,与Cre依赖的报告系统相结合,可高效和特异性地驱动Cre依赖的外源基因在突触后神经元中的表达,以标记突触后神经元。2020年该研究团队再次深入研究了AAV1顺向跨突触标记的作用机制——依赖于突触囊泡的释放,同时揭示了其在多种神经环路中的广泛应用,为AAV1作为顺向跨突触示踪病毒工具对神经元及其投射脑区进行标记提供了诸多证据,如图3所示。

AAV1顺向跨突触标记
(Zingg B et al., J Neurosci, 2020)
此外,张砺教授团队还证实scAAV1-hSyn-Cre相比AAV1载体具有更优越的顺向跨突触标记能力,可在兴奋性、抑制性、神经调质和脑-脊髓等多种神经环路中有效、特异地标记单突触靶神经元及其输出,从而解析不同的功能/行为。
3、可跨血脑屏障的血清型 — AAV9、AAVPHP.B、AAVPHP.eB、AAVPHP.S、AAV.CPP.16
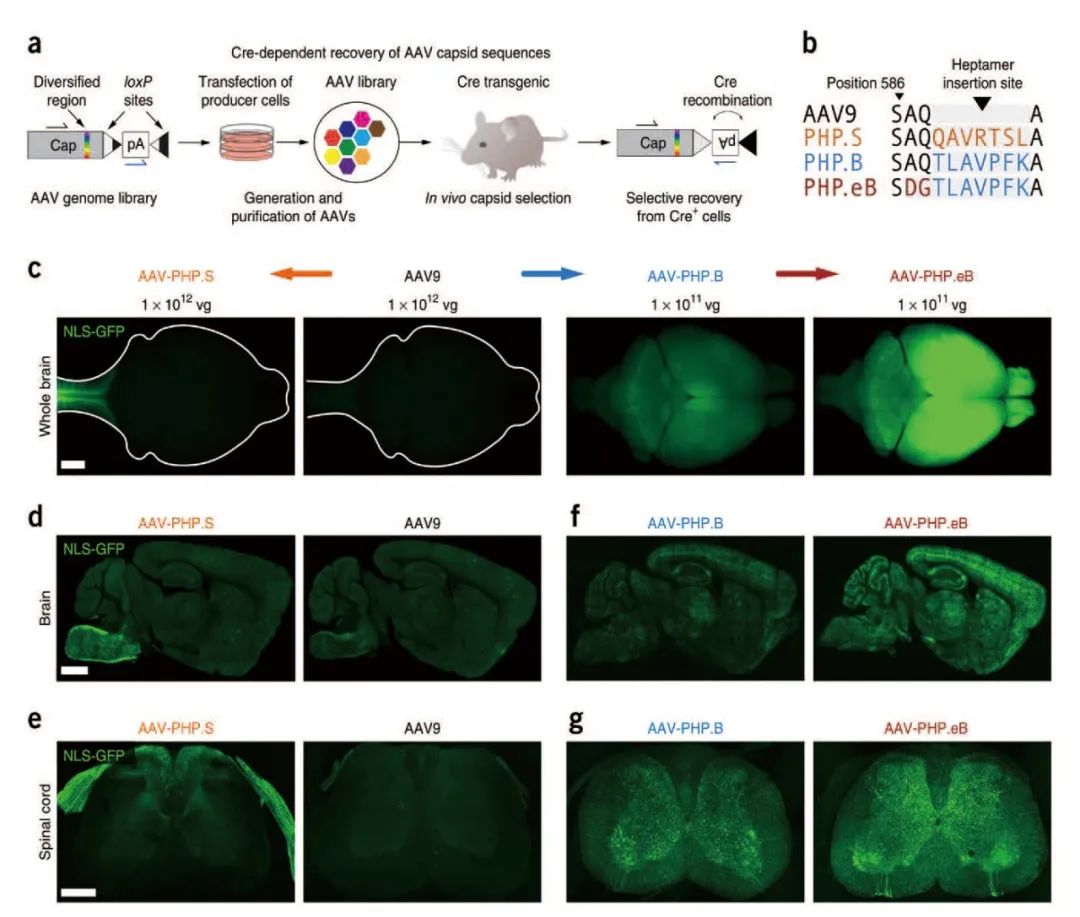
血脑屏障的存在对中枢神经系统有很强的保护作用,但同时它也能阻隔药物的传递和吸收,使神经系统疾病的治疗变得异常困难,研究人员通过进一步改造AAV衣壳,发现AAV9& AAVPHP.B&AAVPHP.eB&AAVPHP.S可以有效介导基因由外周向中枢神经系统的跨越,继而将遗传物质递送至大脑或脊髓中。研究结果显示,AAV-PHP.B可以有效地转导成年小鼠大脑和脊髓的神经元,AAV-PHP.eB降低了诱导大多数中枢神经系统神经元所需的病毒载量,而AAV-PHP.S显示出对周围神经元的更好趋向性。总之,这些AAV变体可以有效介导基因由外周向中枢神经系统的跨越,更好地应用于神经环路研究。
AAV9& AAVPHP.B& AAVPHP.eB& AAVPHP.S有效介导基因由外周至中枢神经系统的跨越
(Ken Y Chanet al., Nat Neurosci, 2017)
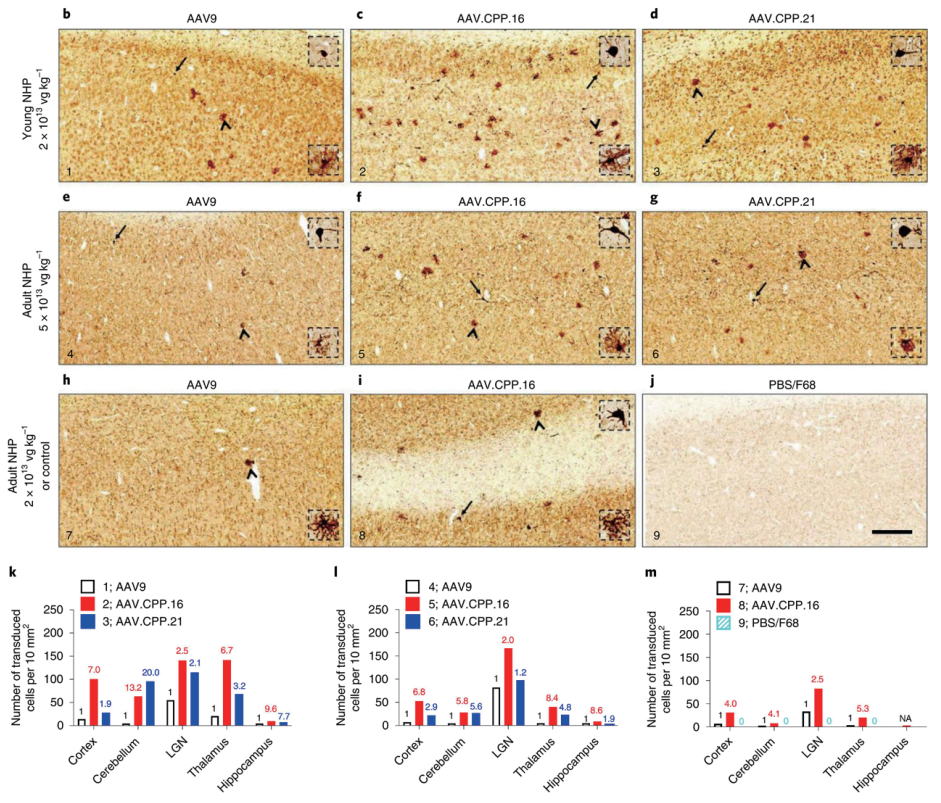
美国哈佛大学联合武汉大学人民医院研究团队利用合理性设计的方法,将选定的细胞穿透肽 CPP(一 组可以穿过细胞膜或组织屏障的短肽)分别插入 AAV9 衣壳(Q588 和 A589 之间)生成突变体库, 将包装好的 AAV 突变体通过静脉注射至小鼠体内,经过序列优化和筛选测试,得到血脑屏障穿透性显著优于 AAV9 的 AAV.CPP.16。通过在不同品系小鼠和食蟹猴动物模型中进行验证,发现静脉注射AAV.CPP.16 可以高效跨越血脑屏障,感染 CNS 神经元细胞、星形胶质细胞以及脊髓运动神经元。基于小鼠与食蟹猴研究结果发现,系统给药 AAV.CPP.16 仍可感染肝脏、肌肉、心脏等外周脏器,但在检查的组织中均未观察到明显的病理反应,也未引起背根神经节退化变性。重要的是,研究人员发现AAV.CPP.16 可用于 GBM 小鼠模型的基因治疗,并具有持久高效的抗肿瘤作用。
AAV.CPP.16 对食蟹猴的脑部转导效率显著优于AAV9
启动子:CAG 实验动物:新生食蟹猴(3 月龄)/ 成年食蟹猴(3-4 岁)
注射方式:静脉注射 病毒用量:新生食蟹猴 2×10E13vg/kg,成年食蟹猴 5×10E13vg/kg
(Yao et al., Nat Biomed Eng, 2022)
4、可高效靶向神经元细胞的血清型—AAV.CAP-B10
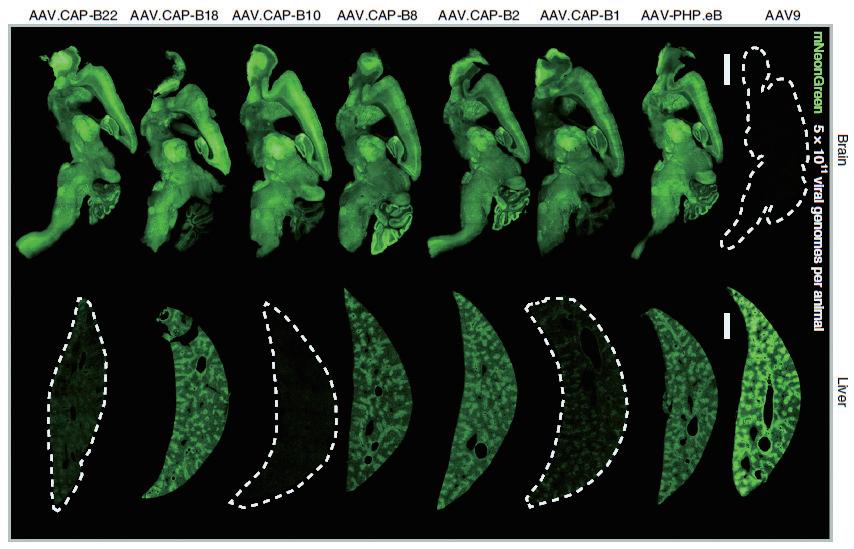
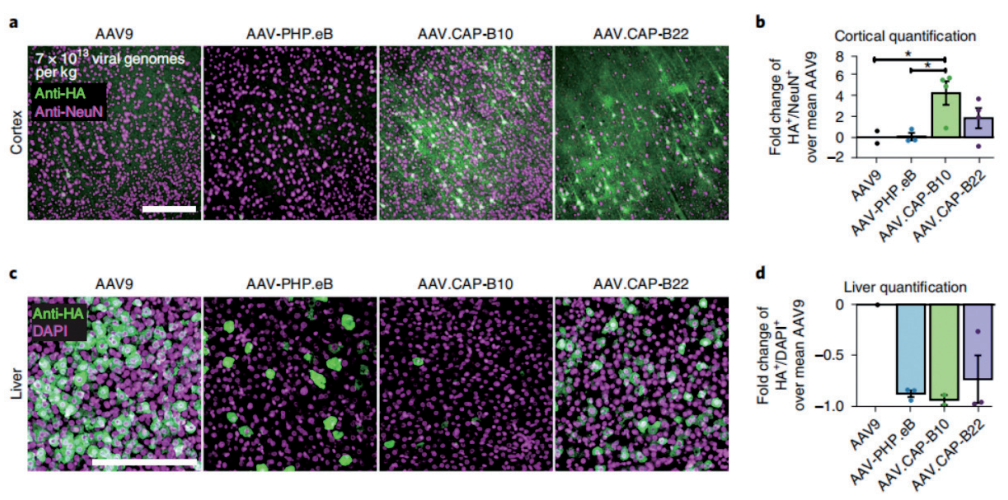
加州理工学院的 Viviana Gradinaru 团队通过对 AAV9 进行衣壳改造,开发了一系列 AAV 变体,其中AAV.CAP-B10,静脉注射后,不仅能够突破血脑屏障,高效靶向神经元细胞,同时不会在肝脏富集。
该研究团队对比了不同 AAV 血清型通过静脉注射在各组织器官中的递送效率,结果发现,AAV. CAP-B10 表现出对中枢神经系统的特异性,高度靶向神经元细胞,对肝脏具有低靶向性,这一结果不仅在小鼠上得到了证实,在非人灵长类动物狨猴上也得到了证实。这为脑研究工作者提供了新的工具策略,同时这也为脑部疾病提供了一种更安全、有效的治疗选择。
AAV.CAP-B10 高效靶向小鼠脑组织而非肝脏
启动子:CAG 实验动物:雄性 C57BL/6J 小鼠
注射方式:静脉注射 病毒用量:5×1011VG/mice
(David Goertsen et al., Nature Neuroscience, 2022)
在狨猴中,AAV.CAP-B10 特异性靶向神经元
启动子:CAG;实验动物:成年狨猴;
注射方式:静脉注射;病毒用量:7×1013VG/KG
(David Goertsen et al., Nature Neuroscience, 2022)
5、可高效靶向星形胶质细胞的血清型—rAAV11
星形胶质细胞是中枢神经系统损伤的关键反应细胞,在脊髓损伤的发病机制中发挥着重要作用。星形胶质细胞功能障碍已被证实是脑卒中、阿尔茨海默病、帕金森病和亨廷顿病等神经退行性疾病的核心特征。中科院徐富强团队对一系列工具病毒进行改造和筛选,开发了一种新的高效逆行靶向投射神经元的重组腺相关病毒 rAAV11。研究发现,rAAV11 可以高效逆行靶向投射神经元,且不表现出顺行跨突触特征;rAAV11 还具备优秀的逆行标记效率,能示踪 rAAV2 难以转导的投射神经元。值得注意的是,rAAV11 可以高效且特异性靶向星形胶质细胞,为星形胶质细胞的研究提供了更加有力的病毒工具。
rAAV11 靶向星形胶质细胞
启动子:GfaABC1D;实验动物:C57BL/6J 小鼠;
注射部位:齿状回(DG)区;病毒用量:2×109 VG/mice
(Han et al., bioRxiv preprint, 2022)
6、可高效靶向小胶质细胞的血清型—AAV-cMG & AAV-MG
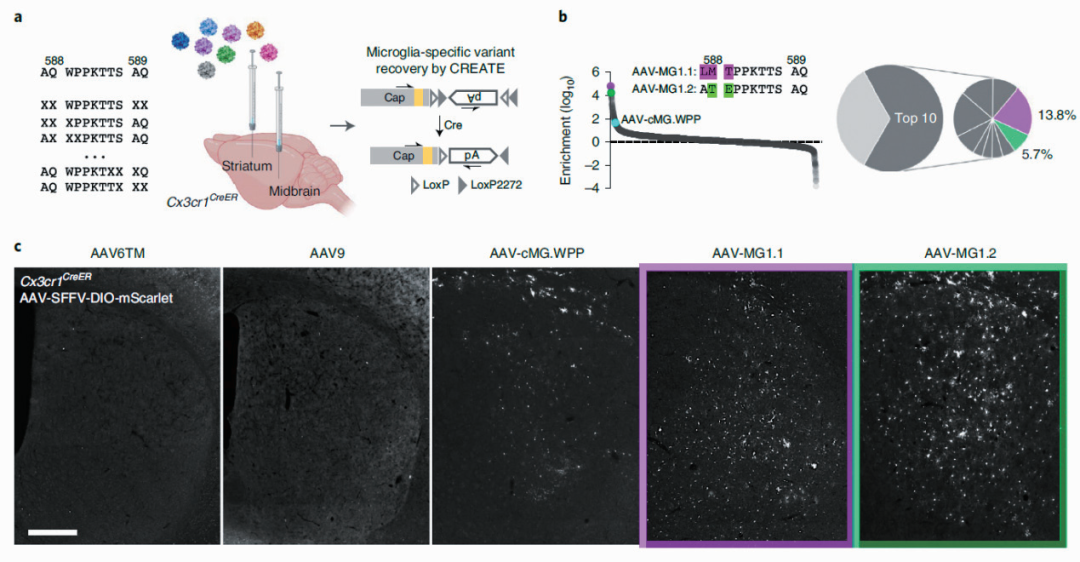
北京生命科学研究所罗敏敏实验室通过定向进化策略,开发了一系列能够在体内和体外高效侵染小胶质细胞的新型 rAAV 载体。该研究针对 AAV9 的衣壳蛋白进行改造,鉴定筛选出两个衣壳蛋白(AAV-cMG. WPP 和 AAV-cMG.QRP)能够在一定程度上提高 rAAV 病毒对体外培养的小鼠小胶质细胞的侵染效率。以此为基础,研究团队针对 AAV-cMG.QRP 的插入肽段及其在衣壳蛋白插入位点的相邻氨基酸进行突变筛选,成功得到了高效侵染体外培养小胶质细胞的 AAV-cMG 衣壳蛋白,同时并不导致小胶质细胞的激活。
体外筛选得到 AAV-cMG
启动子:CMV;转染细胞:小胶质细胞;MOI:104
(Lin et al., Nature Neuroscience, 2022)
研究人员进一步在 AAV-cMG.WPP 基础之上构建新的 AAV 突变文库,并在小胶质细胞特异的 Cx3cr1-CreER 转基因小鼠脑内进行针对性体内筛选,成功鉴定得到 AAV-MG1.1 和 AAV-MG1.2,能够在体内高效侵染小胶质细胞,且不诱导小胶质细胞免疫激活。
体内筛选得到 AAV-MG1.1/1.2 高效转导小胶质细胞
启动子:CMV;实验动物:Cx3cr1-CreER 转基因小鼠;
注射部位:纹状体(800nl)和中脑(500nl);
病毒滴度:5×107 vg.µl-1
(Lin et al., Nature Neuroscience, 2022)
这两类分别适用于体外侵染培养小胶质细胞(AAV-cMG)和体内侵染内源性小胶质细胞(AAV-MG)的新型 rAAV 载体,将有助于小胶质细胞生物学及相关疾病机制的研究。
7、可高效靶向中枢血管内皮细胞的血清型—AAV-BI30
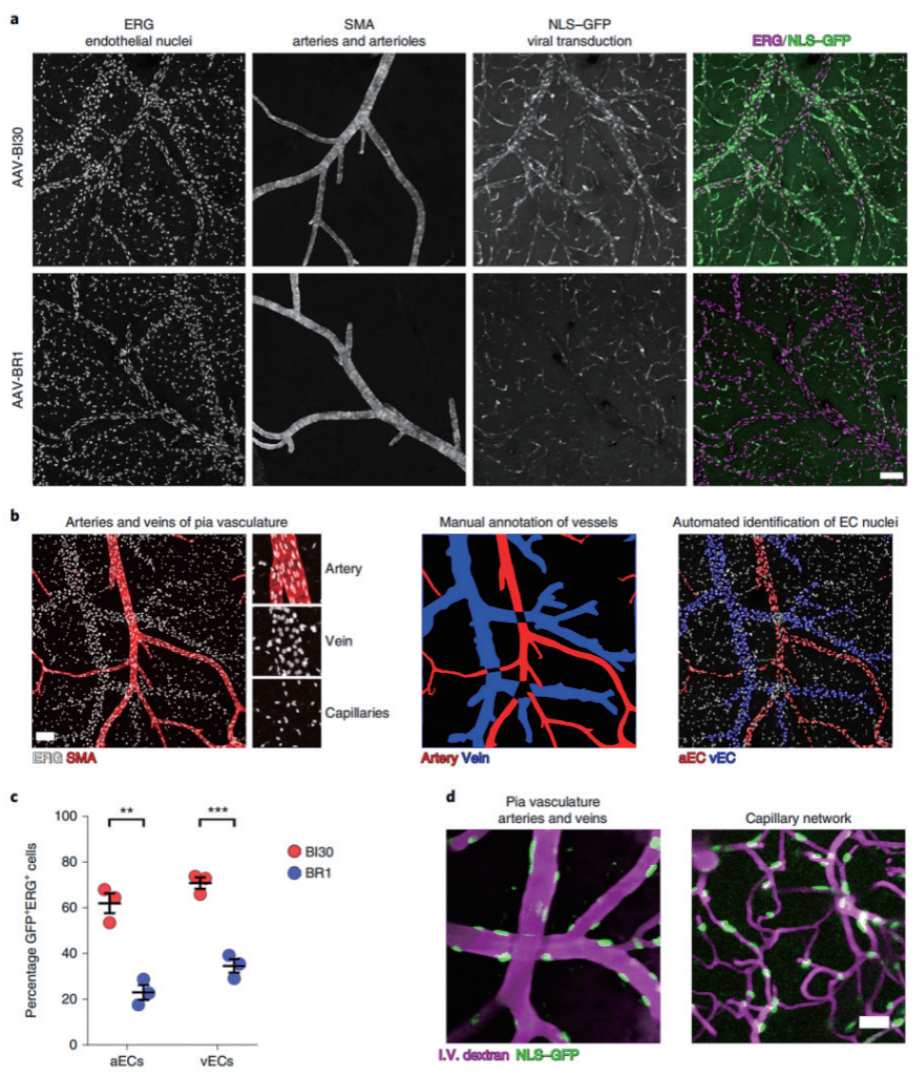
脑血管内皮细胞是表达在血管腔隙的一类中枢非神经元细胞群体,作为血脑屏障的重要组成部分,参与许多关键的生理过程。美国麻省理工学院-哈佛大学布罗德研究所的 Benjamin E. Deverman 组和哈佛医学院的 ChenghuaGu组开发了一种新的血清型 AAV-BI30,可在多个鼠系体内以及体外高效转导内皮细胞。在相对较低的全身剂量下,该载体可转导成年 C57BL/6 小鼠大脑、视网膜和脊髓血管系统中的大多数动脉、毛细血管和静脉内皮细胞。
AAV-BI30 能有效地通过动静脉轴转导大脑内皮细胞
启动子:CAG; 实验动物:成年 C57BL/6J 小鼠;
注射方式:静脉注射; 病毒用量:1×1011 vg/mice
(Krolak et al., NATuRE CARDIoVASCuLAR RESEARCH,2022)
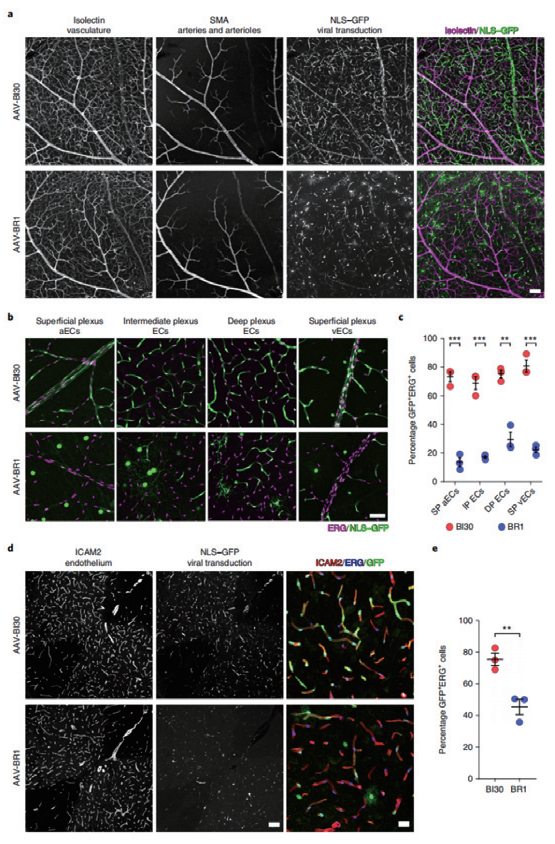
AAV-BI30 靶向视网膜和脊髓血管系统的内皮细胞
启动子:CAG;实验动物:成年 C57BL/6J 小鼠;
注射方式:静脉注射;病毒用量:1×1011 vg/mice
(Krolak et al., NATuRE CARDIoVASCuLAR RESEARCH, 2022)
此外,AAV-BI30 在 CNS 中能实现高效的 Cre 介导的基因操纵。AAV-BI30 能高效的在中枢不同类型血管内皮细胞中特异性表达,适用于神经血管生物学相关研究,并有助于开发内皮功能障碍类疾病的治疗方法。
二、AAV载体的优化选择(ssAAV or scAAV)
根据细胞类型与实验目的选择好合适的血清型后,还可以进行实验需要进行AAV载体的优化选择。腺相关病毒为单链DNA病毒(ssAAV), 在入核、脱衣壳后,需要借助宿主DNA聚合酶或者分子间退火完成双链转化,才能启动基因转录过程,这一过程限制了AAV载体介导的基因转导,并直接影响病毒的感染效率。自身互补双链DNA的腺相关病毒(scAAV)能够克服这一限制,不需要经历一个由单链变为双链的过程,也就是说,双链AAV病毒进入细胞后,可以直接表达,并且表达时间更快,表达水平更高。因此,在神经研究中,也可以根据需要选择scAAV载体,完成目的基因更快表达,或者基因更强表达的研究。
三、启动子的选择
除了AAV载体与血清型,启动子和调控元件的优化也十分必要。目前,研究中使用的广谱型启动子,如巨细胞病毒启动子CMV、CMV增强子融合的鸡ß-肌动蛋白启动子CAG等,可实现目的基因的高表达。四环素启动子TRE作为诱导型启动子,则可以在特定条件下启动基因的表达。然而,神经系统的组成极其复杂,脑部的精密研究非常关键,要想实现某个脑区甚至是某一类细胞的特异性感染,选择一种特异性相对更强的启动子尤为重要。
常见的神经组织特异性启动子
四、转录后调控元件的添加
AAV载体上转录后调控元件的添加,对于mRNA的剪接及核输出、mRNA的稳定性及翻译等具有重要意义,下面列举两个对于提高外源基因表达非常重要的转录后调控元件。
1、内含子
真核mRNA内含子在真核生物基因表达调控中起着重要的作用,是转基因研究中提高外源基因表达的重要元件之一。在多数情况下,真核mRNA内含子的存在可以提高基因的表达水平,因为其剪接过程会影响mRNA新陈代谢的多个阶段,包括转录、RNA编辑、pre-mRNA的加工、mRNA的出核运输、翻译等。所以说,在载体容量允许的情况下可添加一个内含子,有助于刺激基因的表达。
2、WPRE元件
土拨鼠肝炎病毒转录后调节序列WPRE是一段顺式作用的RNA元件,放在多聚腺苷酸化信号之前可显著增加mRNA的表达水平和翻译效率,进而增强基因的表达,并且WPRE插入病毒载体中还可以大大提升病毒包装的滴度。然而由于WPRE序列较长(600bp左右),所以还需要视具体的载体容量选择性插入。
五、注射方式的选择
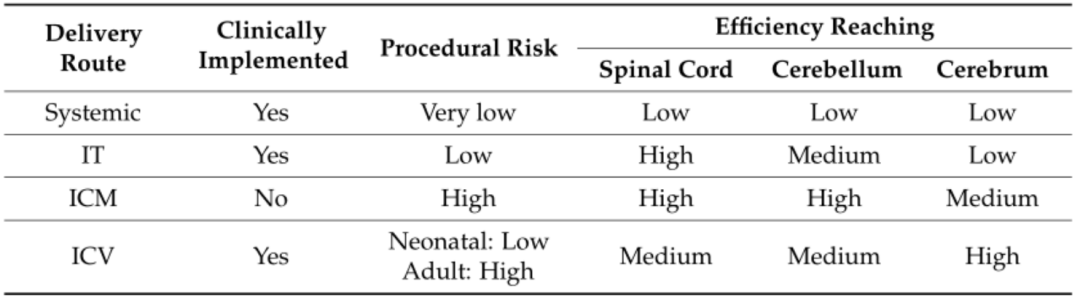
目前AAV在神经系统研究中的注射方法主要有以下几种:脑实质内注射、静脉注射、脑室注射(ICV)、枕大池内注射(ICM)和鞘内注射(IT),其中ICV、ICM和IT注射是通过脑脊髓液进行传递。每种注射方式各有优缺点,研究者可根据具体的研究对象以及实验方案,选择适合的注射方式,推荐进行预实验对实验效果做初步测试,以得到更优的选择方案。
四种常用AAV神经给药特点
(Ocana-Santero G et al. ,International Journal of Molecular Sciences, 2021)
下面介绍几种常用注射方法及相应的病毒注射剂量:
(1)脑立体定位注射
脑立体定位注射,相比其他注射方式靶向性强,注射病毒体积小,但是侵入性也强,且对操作者具有很高的要求。在立体定位手术时,颅骨上常用的注射参照点是前囟,也就是中矢状冠状缝的交叉点(下图B中的十字交叉点)。具体操作步骤如下:
1. 实验动物称重,进行麻醉;
2. 待实验动物完全麻醉后,用剃毛器将动物头顶眼睛至耳朵之间的毛发剃除干净;
3. 将麻醉后的实验动物固定于脑立体定位仪上;
具体操作为:实验动物眼部涂抹青霉素眼药膏以保护其双眼;将门齿挂在门齿挂钩上,确保头部保持固定;检查左右耳杆是否在同一水平上,将左右耳杆通过外耳道插入实验动物耳内。实验动物固定好的标准为:鼻对正中,头部不动,提尾不掉,目测大脑放置水平;
4. 手术:用碘伏/ 无色葡萄糖氯己定溶液对实验动物头皮进行消毒清理,用手术刀沿中间位置剪开头皮,用镊子对表面的结缔组织进行清理,暴露实验动物的颅骨表面;然后进行调平,首先找到前囟这个坐标,并将其归零,然后向左右调平,使左右两侧处于同一水平,调整前后囟,使前后囟也在同一水平;
5. 病毒注射:通过查询实验动物的脑立体定位图谱确定待注射脑区的位置(下方图片是大鼠和小鼠的脑谱),并确定其坐标值,即ML 值(X 轴)、AP 值(Y 轴)、DV 值(Z 轴);根据目标脑区设定好坐标,移开注射针,用颅骨钻开窗( 由于颅骨薄, 故务必注意颅骨钻的力度!!), 操作时避免伤及脑组织;微量注射器吸取病毒液,随后固定在定位仪上,根据设好的坐标进行病毒注射,注射速度控制在0.1-0.15μL/min,注射剂量视具体实验而定。注射完毕,留针10min,以便病毒液充分吸收,然后慢慢回针;
6. 缝合头皮并消毒, 完成脑定位注射; 将动物从脑立体定位仪取下, 回笼待苏醒; 动物苏醒后,正常喂养, 病毒注射后2-4 周可检测转基因的表达。
提示:若手术麻醉时间较长,建议不要用酒精消毒,防止酒精挥发导致动物体温过低而死亡。手术过程和苏醒过程注意保暖。
脑立体定位注射示意图
(Van der Perren A et al. JOVE-J VIS EXP. 2016)
(2)鞘内注射
与系统注射和实质内注射相比,鞘内给药是一种具有较低剂量要求的微创替代方法。步骤如下:
1、使用毛巾覆盖在小鼠头部和背部,露出髂嵴以下的腰部区域;用非惯用手的拇指和食指抓住鼠的髂骨(髋骨),手的顶部轻轻放在小鼠身体和头部上,使其保持平静。
注:在髂骨上的握力应该足够强,以固定小鼠的腿部活动,并使腿部向外和向下伸展。
2、使用惯用手食指从腰椎到骶部沿脊柱轻轻按压,同时使用非惯用手轻轻上拉小鼠,以打开椎节之间的空间,方便进针。
3、将1 ¼”号针的斜面指向小鼠头部,然后将针以70°角插入脊柱中线的腰椎处,当感觉针碰到骨头时,将针的角度调整到30°夹角,并将针插入椎节之间。
注:需多次尝试找到合适的进入点,针头进入脊柱后推针没有阻力,尾巴或后腿的反射性弹跳出现时,说明已正确入针。
4、轻轻压下注射器的活塞,将5-10μL的AAV病毒悬液注射至蛛网膜下腔。
注:注射时间控制在10-30s较好,速度太快会导致小鼠后腿抽筋,该现象会在60s内消失。
5、注射后,将针180°旋转1-2次,然后将针从脊柱中取出。
6、小鼠放回笼子观察,确认恢复正常运动功能。
注:此法适用于成年小鼠或大鼠。
(3)静脉注射
系统性给药方式,侵入性较小,但是相比其他注射方式特异性也较差,因此所需病毒体积更大。步骤如下:
新生小鼠的颞静脉注射
1、调整光源位置以便照亮显微镜区域,中等强度的光照为佳。
2、将一个新生幼鼠直接置于冰上1-3min,进行麻醉。
3、当动物在冰上麻醉时,在注射器中注满AAV病毒,注射体积不应超过100μL。
4、在显微镜下观察幼鼠。用不持注射器的手的食指放在幼鼠口鼻处,中指放在耳芽处,以便拉伸幼鼠的皮肤,可见颞浅静脉。
5、确定颞浅静脉。可通过皮肤看到位于耳芽前部,周围毛细血管下部,有一条隐约可见的静脉血管,从背部到腹部,汇入颈静脉,这就是颞浅静脉。
6、注射器针尖斜面插入颞静脉。可以看到针尖斜面通过皮肤的以后被血填充。轻压注射器,并注意幼鼠脸侧面的静脉变白。
成年小鼠眶后静脉注射
1、注射异氟醚对小鼠进行麻醉,使用非惯用手手掌握住小鼠背部,将拇指放在气管正侧面,头部皮毛拢至手掌,使小鼠眼球凸起。
2、将手腕支撑在稳定的表面上,用拇指、中指和无名指握住注射器,将食指放在柱塞上方。
3、对小鼠施加轻微压力使眼睛凸出,针头对准内眦,斜面朝外,将针头以45°插入眶后窦中心约5mm;
4、使用0.5ml 28G注射器缓慢注入150-200μL病毒悬液;
5、缓慢地取出针头,确保针头不会划伤眼角膜。使用无菌纱布止血,并在眼睛上涂抹药膏助其恢复。
6、注射后,将小鼠放回笼中恢复直至清醒。
成年小鼠眶后静脉注射
(Gessler D J et al. Methods Mol Biol. 2019 )
尾静脉注射
1、将小鼠放入约束器中,使尾巴从开口处露出。避免过度限制小鼠,以免导致其呼吸受阻。
2、在尾部涂抹70%异丙醇。
3、将小鼠尾巴拉直,可看到尾巴两侧各有一条侧脉。
4、将针尖以30°角插入侧静脉中。一旦针尖穿过了静脉的一半,重新调整针头,使其与静脉的长度一致(图3c)。如果针头插入正确,则按压注射器注射时应无阻力。
5、使用0.5ml 28G注射器缓慢注射300μLAAV病毒悬液,此时静脉颜色会变白,大约4s后,颜色恢复正常。
6、小心将针头取出,用吸水纱布按压注射部位10秒进行止血。
7、将小鼠放回笼子。

尾静脉注射
(Gessler D J et al. Methods Mol Biol. 2019 )
小结
值得注意的是,除了以上所述各项因素外,AAV病毒本身的滴度和纯度,目的基因本身的自然属性(如胞内蛋白/分泌蛋白/转运蛋白)以及AAV感染后所使用的检测方法等因素也会影响到基因最终的表达效果。因此,在神经系统研究中,想要驱动更高效的基因转导,可以综合考虑以上各项因素,优化选择。
AAV在脑组织中的靶向策略(应用篇)(可点击查看)
 当前位置:首页 > 研究领域 > 神经系统
当前位置:首页 > 研究领域 > 神经系统