AAV在肠道中的靶向策略
肠道是人体重要的消化器官和排毒器官,同时也是重要的免疫器官,有将近70%以上的免疫细胞分布在肠黏膜上,担负着人体70%以上的免疫功能。肠道相关疾病发病机制的破解和治疗所面临的挑战,使得研究肠道基因靶向技术研究迫在眉睫。虽然目前已有大量利用病毒载体进行基因转移的临床前数据,但在肠道中的研究仍然较少。
对于肠道的早期研究主要集中在粘膜转导上,但由于肠道管腔条件恶劣及肠细胞代谢周转率较高导致其成功率较低。重组腺相关病毒(rAAV)因其血清型种类多、表达时间长以及低免疫性的特点使肠道基因转移的效率得到提高,但是如何提高AAV在肠道中转导效率和特异性细胞靶向仍是肠道基因治疗需要克服的障碍。
一、AAV血清型和启动子的选择
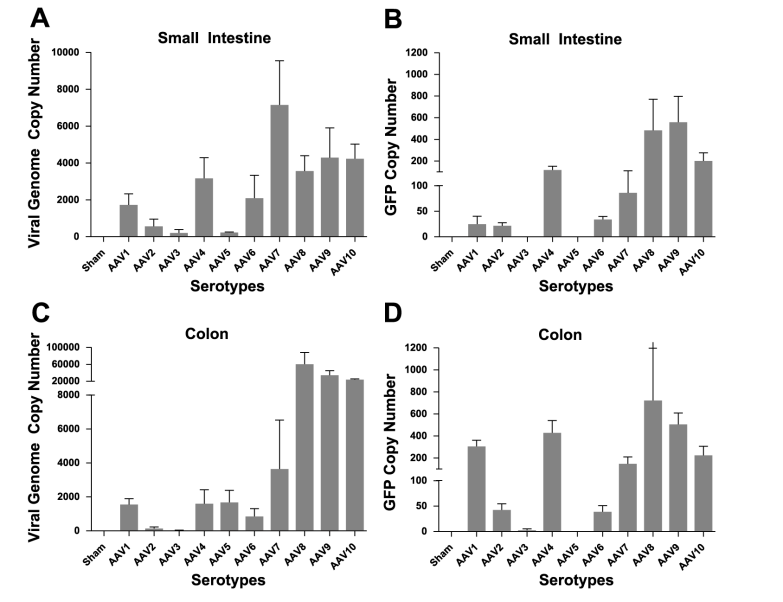
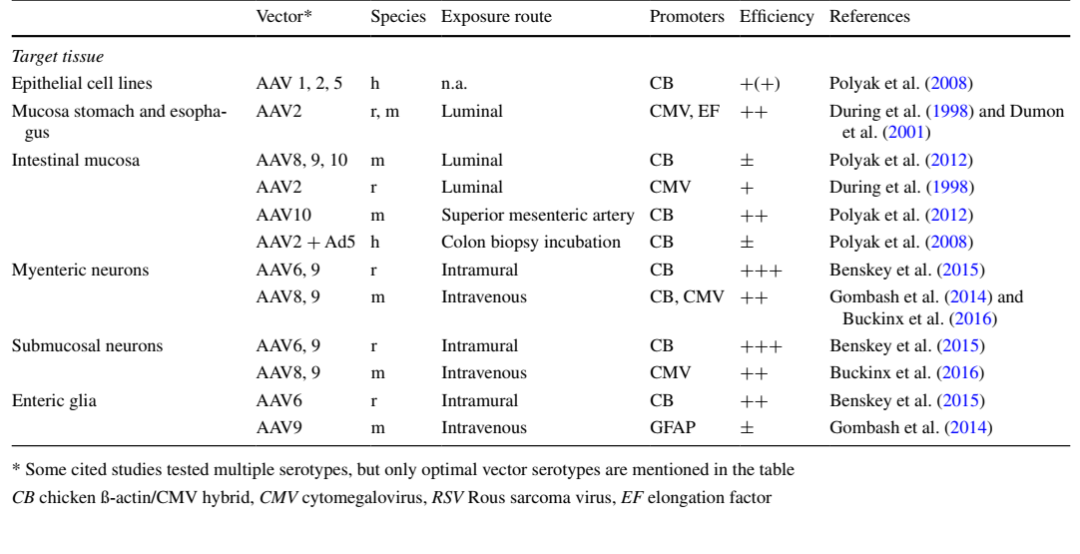
AAV2、AAV7、AAV8、AAV9和AAVrh10对肠道组织的转导效率较高,其中AAV7对小肠的感染效率相对较高,AAVrh10已被证明能够在肠道中长效表达外源基因,尤其是在结肠中,目前研究中应用较多的血清型是AAV9。肠道研究中,启动子通常选择广谱型启动子CMV。
图1 SMA注射AAV后小肠(SI)结肠(Colon)中AAV血清型趋向性和转导效率比较
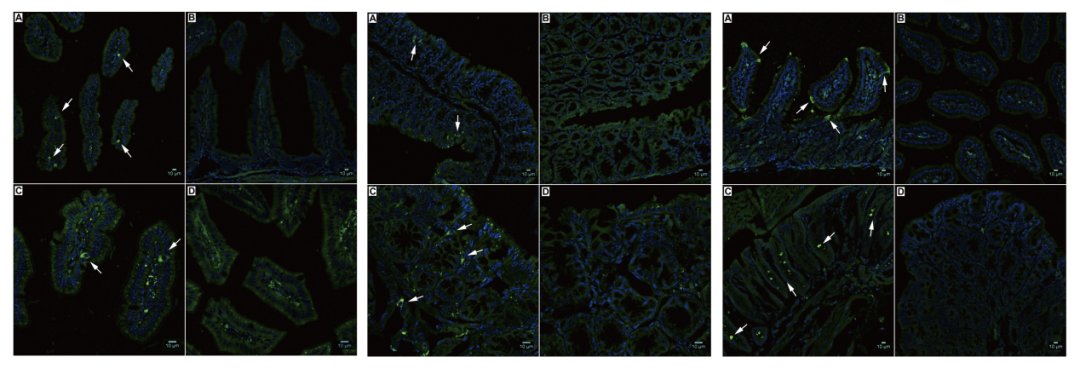
图2 AAV8、AAV9、AAV10注射后GFP荧光图
(A、B:小肠,C、D: 结肠)
(Steven P , Annette M , Stacy P , et al. Am J Physiol Gastrointest Liver Physiol, 2012.)
下表为AAV靶向肠道不同部位较优血清型和启动子的总结:
(Buckinx R , Timmermans J P . Histochemistry & Cell Biology, 2016.)
二、注射方式和注射量
肠组织常见的注射方式有尾静脉注射、腹腔注射、口服、灌肠和肠系膜上动脉(SMA)注射等。其中尾静脉注射和腹腔注射作为系统性给药方式,虽然操作简单,损伤性小,但是注射量较大,特异性不强。口服和灌肠,都属于腔内给药,主要是黏膜的转导,由于胃酸及肠蛋白水解酶等的中和作用,因此这两种方式的转导效率并不高。在这几种注射方式中,SMA注射效果较好,但对实验条件和操作手法要求较高,对小鼠伤害性也较大。口服和系统性注射的方式此处不进行赘述,下面分享灌肠和SMA注射的操作步骤供参考:
灌肠
(1)小鼠禁食过夜,并预先用N-乙酰-L-半胱氨酸(NAC)和毛果芸香碱处理以促进肠道隐窝黏液排出。
(2)使用异氟醚将小鼠麻醉。
(3)在不使用镇静剂的状态下,用1英寸不锈钢的直圆针头直肠注射300μL 20mM的NAC清洗结肠30min。
(4)再次麻醉小鼠,通过灌肠给予小鼠5*10E10vg,600μL体积量的AAV。
注:可通过直肠注射亚甲基蓝观察液体到达盲肠的预实验,确定合适的灌肠液体积。
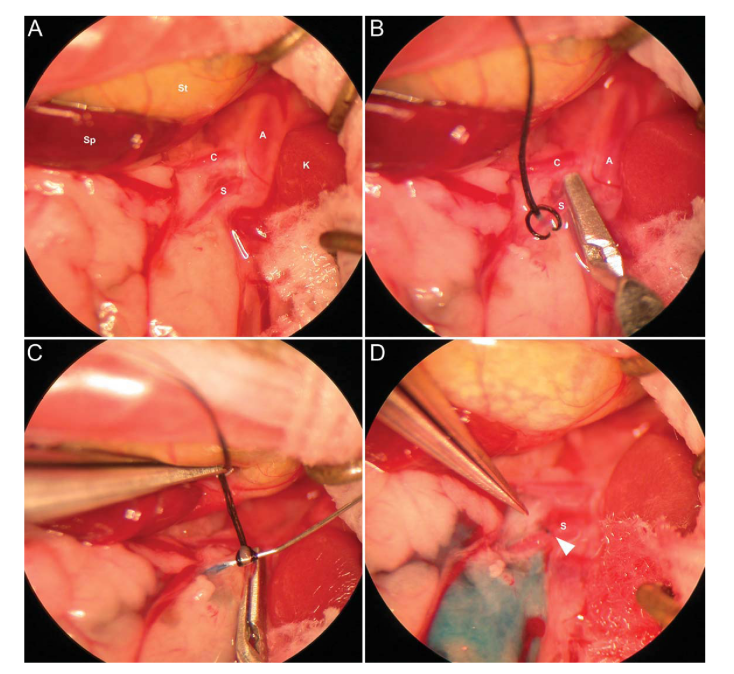
肠系膜动脉(SMA)注射
(1)将小鼠以右侧卧位固定在手术板上,保持四肢松弛,放入含2-4.5% O2的异氟醚诱导室进行麻醉。小鼠深度麻醉后,将其放在手术台上,对小鼠手术区域做去毛及消毒处理。
注:为保持小鼠体温,可在手术板下放置加热垫。整个手术过程在手术显微镜下放大5-40倍进行操作。
(2)手术开始前,皮下注射丁丙诺啡进行手术镇痛;沿左腋线最后一个肋间隙和肋下区域注射布比卡因进行局部镇痛。
(3)沿着腋线和侧腹,在脾脏区域的左侧皮肤上开一个1-2 cm的切口,切开腹外斜肌,使用微型牵引器将皮肤和腹壁固定,并用温盐水纱布覆盖小肠防止缩回,暴露SMA。
(4)在放大20倍的情况下,将SMA轻轻地从腹膜后剥离,在SMA的近端接头周围放置一个小的稳定接头连接注射针,使用微血管夹暂时切断腹主动脉的血液供应。
(5)将定制33号1/2”针头连接到250μL汉密尔顿TLL气密性进样针注射器上,轻轻插入SMA进行病毒注射(1*10E11vg, 200μL体积的AAV8)。将固定带轻扎血管,防止注射部位泄漏。
注:注射过程中使用显微镜观察以确保注射可视准确。
(6)注射后立即取下针头,缝合注射部位。取下固定带和微血管夹,使血液回流至小肠。使用无菌棉签轻轻按压注射部位进行止血。
(7)在腹腔内注射1mL无菌温盐水后,对小鼠进行缝合。
(8)术后每15min对小鼠进行一次监测,直到小鼠能够腹卧。每2小时对动物进行一次监测,直至放回笼中。
图3 小鼠SMA注射过程中显微手术步骤的代表性照片
(Porvasnik S L , Mah C , Polyak S . Microsurgery, 2010.)
近几年,随着AAV在肠道基因转移中的成功应用,研究人员对肠道相关疾病的发病机制和治疗靶点的探究也有了新的突破。前期,我们已经为大家介绍了AAV在肠道中的应用策略(干货篇),今天小V再带大家一起学习一下维真AAV在肠道研究中的几个应用实例。
客户案例分享1
《Blocking IL- 17A enhances tumor response to anti- PD-1 immunotherapy in microsatellite stable colorectal cancer》
结直肠癌(Colorectal cancer,CRC)在所有癌症类型中发病率排名第三,死亡率排名第二。虽然免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)以及抗PD-1治疗为CRC的治疗带来了曙光,但对微卫星稳定型(microsatellite stable,MSS)结直肠癌患者的治疗非常有限,MSS CRC患者对ICIs的耐药机制尚不明确。研究表明,白细胞介素17A(IL- 17A)与CRC患者的不良预后相关,并且其活性可能会导致抗肿瘤免疫的耐药性,但阻断IL- 17A是否能提高MSS CRC患者对ICIs的敏感性仍不确定。
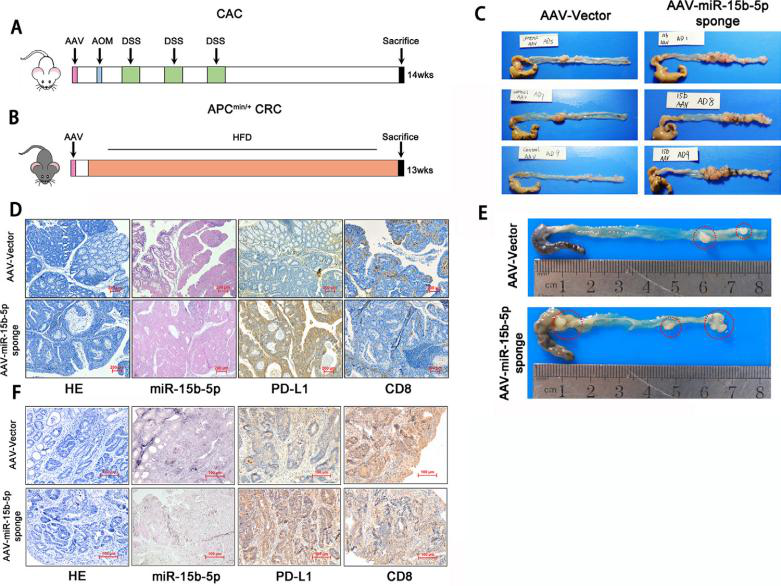
在本研究中,作者首先对临床病理标本进行评估并证实了PD-L1的mRNA水平与CD8+细胞浸润和患者预后相关。在CAC(结肠炎相关肠癌)和APCmin/+CRC模型中,发现miR-15b-5p能在蛋白水平下调PD-L1的表达,抑制肿瘤发生,并增强肿瘤对抗PD-1的敏感性。使用细胞因子IL-17A处理CT26和MC38细胞后发现IL-17A通过调节P65/NRF1/miR-15b-5p通路导致直肠癌细胞中PD-L1高表达。进一步研究发现IL-17A和PD-1的联合阻断可以明显减缓肿瘤生长,延长生存率。本研究提出IL- 17A有望成为增强MSS CRC患者对ICIs治疗敏感性的靶点。
研究人员利用腺相关病毒(AAV-miR-15b-5p sponge)载体感染CAC和APCMin/+小鼠结肠组织,抑制miR-15b-5p的表达。作者观察发现在CAC和APCMin/+结肠癌小鼠模型中,miR-15b-5p表达的阻断明显促进了肿瘤的发生,提高了PD-L1表达,同时显著减少了CD8+细胞数量,说明miR-15b-5p通过靶向PD-L1抑制肿瘤的发生。
图1. miR-15b-5p通过靶向PD-L1抑制肿瘤的发生
客户案例分享2
《MiR155 Disrupts the Intestinal Barrier by Inducing Intestinal Inflammation and Altering the Intestinal Microecology in Severe Acute Pancreatitis》
胰腺感染是导致重症急性胰腺炎(SAP)患者死亡的主要原因之一,研究认为肠道的微生态紊乱和炎症导致肠道屏障破坏,致使肠道菌群移位进而感染胰腺。研究表明,miRNA通过塑造肠道菌群参与宿主免疫功能和炎症的调控。miR155主要表达于胸腺和脾脏,被认为可能通过TLR通路参与肠道菌群介导的肠道免疫应答和肠道屏障破坏,具体作用机制尚需明确。
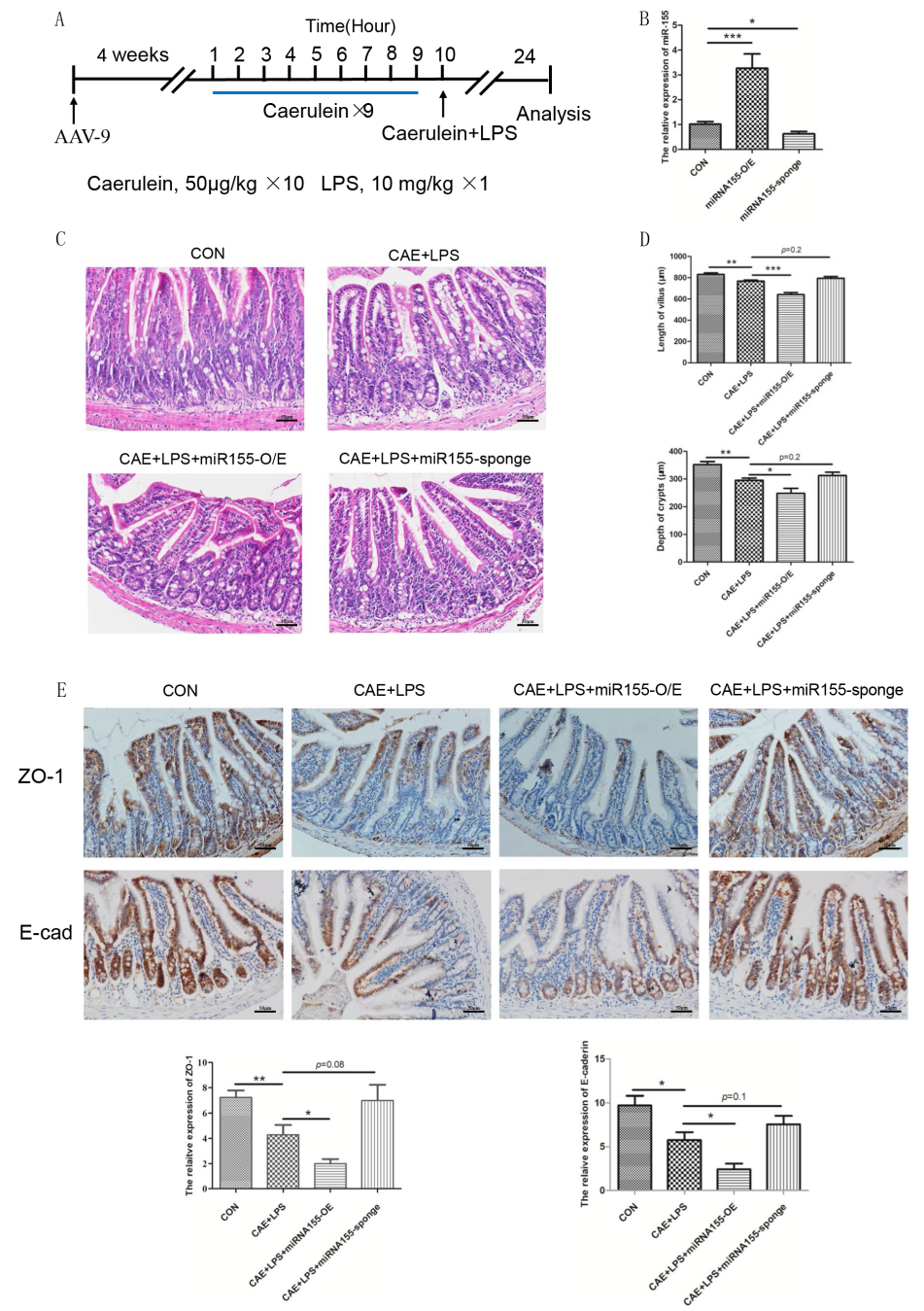
本研究探讨了miR155对小鼠SAP相关肠道功能障碍的影响及其可能机制。通过建立SAP小鼠模型,研究人员发现miR155的过度表达导致SAP小鼠肠道组织损伤加重。采集盲肠组织进行16S rRNA基因测序,显示miR155促进了肠道菌群的失调。进一步检测发现miR155激活TLR4/MYD88通路,从而影响炎症介质的释放,调节SAP相关肠道损伤。对SAP小鼠进行miR155干扰(AAV9--miR155 sponge)后,肠道菌群失衡和肠道屏障相关蛋白的破坏得到了有效缓解,炎症介质释放减少,肠道组织病理损伤明显改善。本研究结果表明,miR155可通过TLR4/MYD88通路加重肠道炎症,破坏肠道屏障,显著改变SAP小鼠的肠道微生态。

为检测miR155在SAP小鼠肠道功能破坏中的作用,研究人员先利用AAV9载体对miR155进行了过表达及干扰处理,而后建立了SAP小鼠模型。检测结果发现注射AAV9-miR155的小鼠小肠中miR155的表达量显著升高,注射AAV9-miR155 sponge后miR155表达量明显下降。miR155过度表达的SAP小鼠小肠组织损伤显著增加,免疫组化检测发现miR155的过表达明显加剧了肠道屏障标志物ZO-1和E-cad的蛋白表达水平的下调。这些结果表明,miR155可能加剧了肠道屏障的破坏,下调miR155的表达可能对肠道屏障起到保护作用。
图2. miR155可加重SAP小鼠肠道屏障的破坏
客户案例分享3
《Arctigenin disrupts NLRP3 inflammasome assembly in colonic macrophages via downregulating fatty acid oxidation to prevent colitis-associated cancer》
牛蒡子苷元是牛蒡子的主要药理活性成分,据报道有抑制肿瘤生长、缓解结肠炎的作用。目前牛蒡子苷元对结肠炎相关癌症(colitis-associated cancer ,CAC)的保护作用及其机制尚不明确。本研究利用偶氮甲烷(AOM)/葡聚糖硫酸钠(DSS)诱导CAC小鼠模型,发现口服牛蒡子苷元可以减缓CAC小鼠结肠炎的进展并预防结肠癌的发生。非靶向代谢组学技术测定发现,牛蒡子苷元下调巨噬细胞中NLRP3炎症小体的激活和脂肪酸氧化(FAO)代谢。进一步研究发现牛蒡子苷元可以抑制肉碱棕榈酰转移酶1(CPT1)的表达,减少α-微管蛋白的乙酰化,破坏NLRP3复合物的形成,从而使NLRP3炎症小体失活。牛蒡子苷元可以通过抑制小鼠NLRP3炎性小体激活并改善CAC,并且AAV9-CPT1的过度表达显著降低了这种作用。本研究阐明了牛蒡子苷元主要通过下调结肠巨噬细胞中CPT1表达和随后的NLRP3炎性小体激活发挥对CAC的保护作用,进而揭示了CPT1在炎性小体激活和结肠癌发生发展中的关键作用,同时也强调了牛蒡子苷元在降低结肠炎患者CAC风险方面的潜在价值。
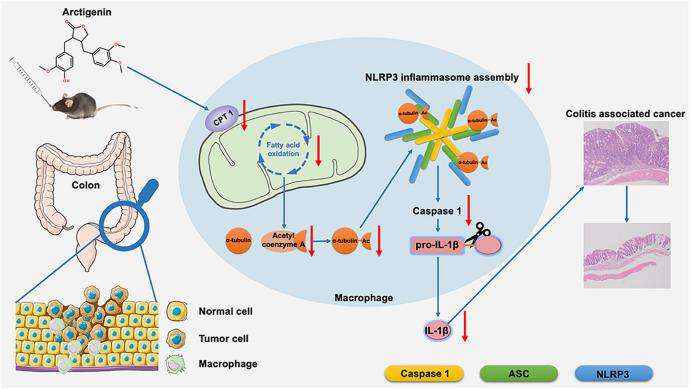
为了确定牛蒡子苷元的抗CAC作用是否与CPT1介导的FAQ下调有关,研究人员使用AAV9作为载体,在CAC小鼠结肠组织中特异性过表达CPT1。结果发现CPT1过表达的小鼠在存活率、体重、结肠长度等方面都有显著降低,且结肠组织肿瘤数量、负载量和大小均显著增加。组织病理学检查显示CAC小鼠和CAC伴CPT1高表达组小鼠结肠粘膜内有大型腺癌。此外,上述两组的小鼠表现出炎症反应和隐窝减少症状,且CD68+ NLRP3+巨噬细胞数量显著增加。CPT1过表达显著增加了IL-1β的表达,同时也促进了结肠组织中α-微管蛋白乙酰化和乙酰辅酶A的产生。牛蒡子苷元对结肠巨噬细胞和CAC中NLRP3炎症体激活的抑制作用随着结肠组织中CPT1的过表达而逐渐消失,以上结果阐明了牛蒡子苷元主要通过下调结肠巨噬细胞中CPT1的表达和NLRP3炎性小体的激活来抑制CAC,同时也揭示了CPT1在炎症小体激活和结肠癌发生进展中的作用。
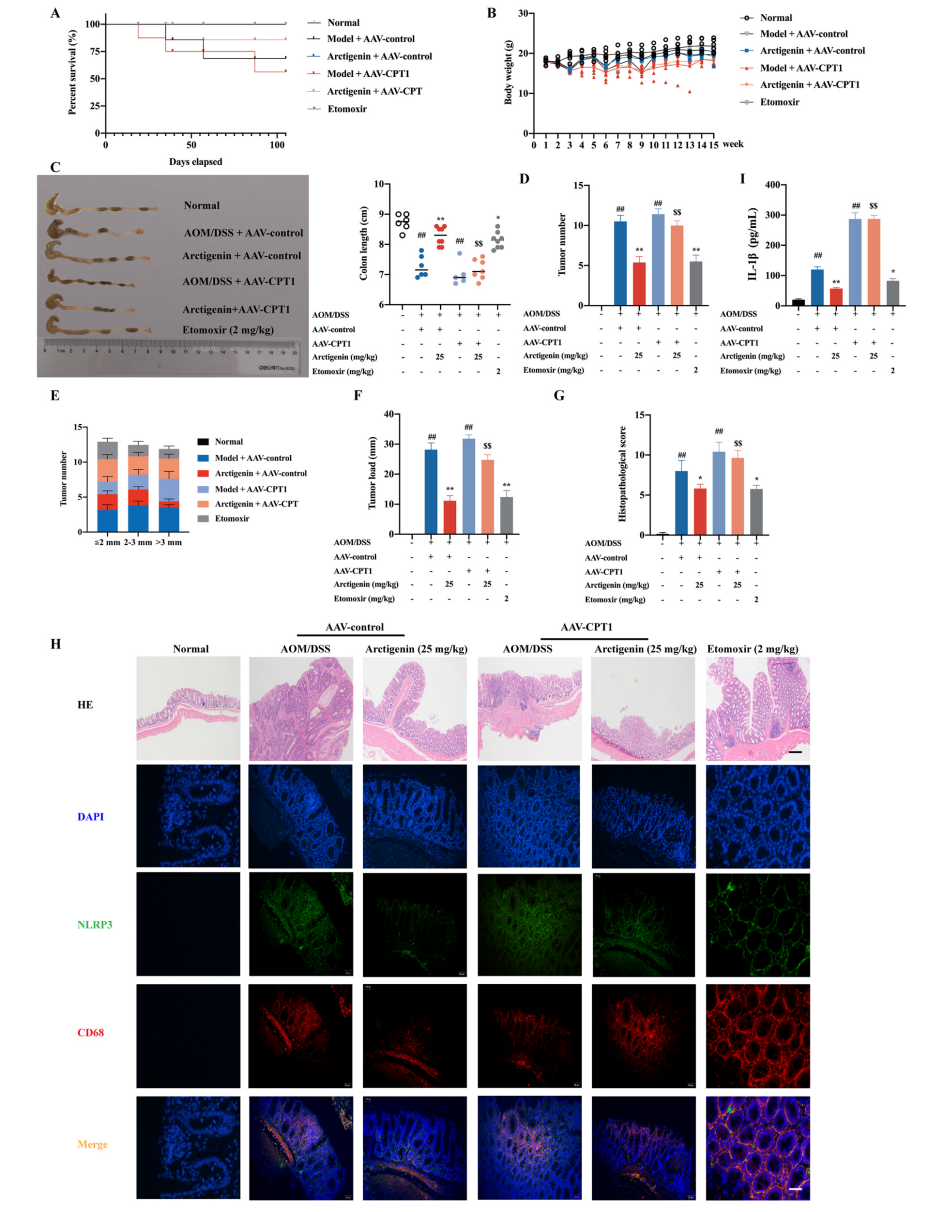
图3. CPT1过表达对牛蒡子苷元抑制小鼠结肠CAC和炎症小体激活的影响
客户案例分享4
使用效果反馈

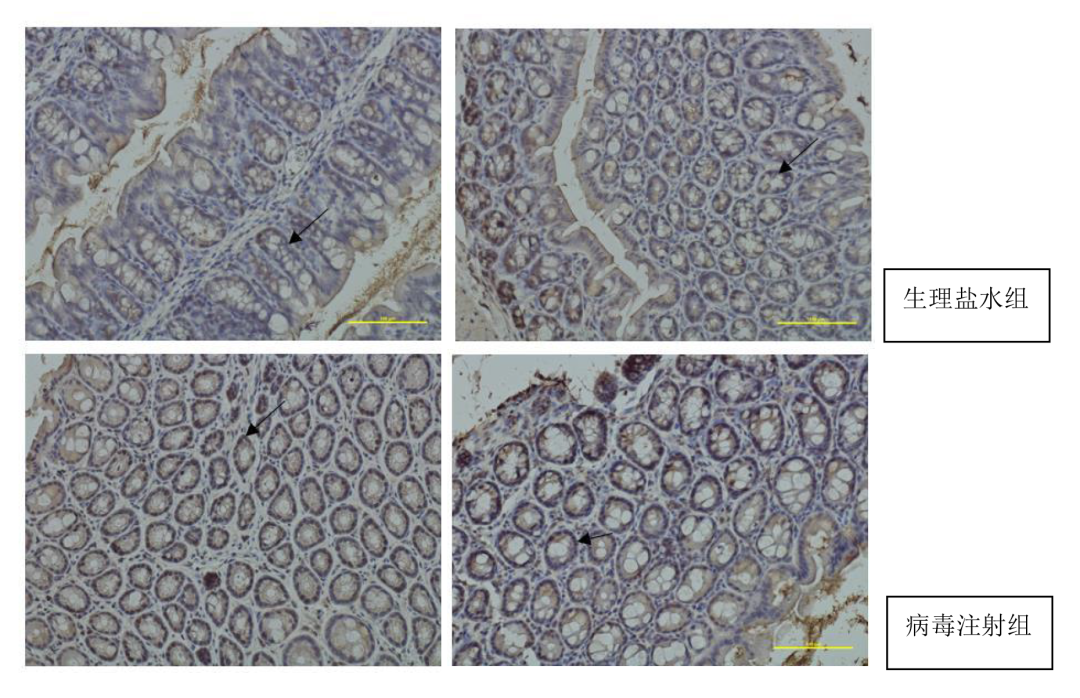
图4. AAV9注射小鼠结肠组织后免疫组化结果
 当前位置:首页 > 研究领域 > 消化系统
当前位置:首页 > 研究领域 > 消化系统