AAV在胰腺研究中的靶向策略(干货&应用合集)
胰腺是重要的分泌器官,由外分泌组织(腺泡)、内分泌组织(胰岛)、胰管和血管组成,这些结构的功能障碍会导致不同的胰腺疾病发生。鉴于胰腺的解剖位置和复杂结构,胰腺疾病的基因治疗需要针对不同胰腺部位进行有效的基因传递。多项研究表明,相比腺病毒和慢病毒而言,腺相关病毒更能有效转导胰腺,已作为一种明星载体在胰腺研究中展开应用。今天小V就带大家一起学习一下rAAV在胰腺基因工程中的选择策略。
一、血清型的选择
研究表明AAV8在胰腺中具有相对较高的转导效率。
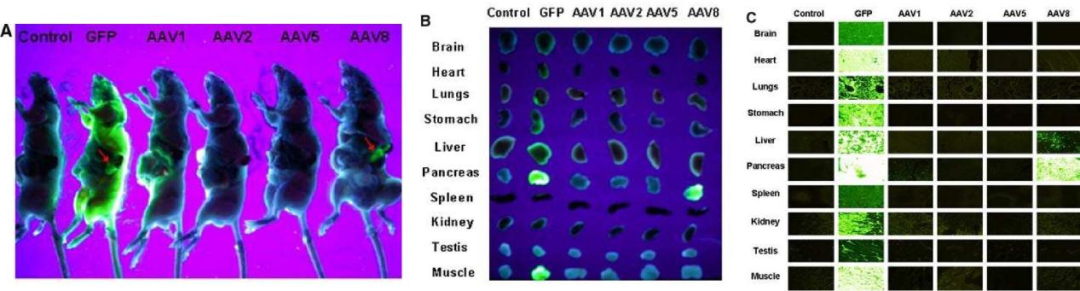
Cheng H等研究证明,AAV8对胰腺的转导效率优于AAV1、AAV2、AAV5血清型,且持续表达时间较长(图1);进一步通过胰腺导管给药观察不同血清型的组织分布发现AAV8可以高效转导胰腺组织(图2),并且转导效率呈剂量依赖式增加(图3)。
图1.不同AAV血清型和慢病毒对胰腺的转导效率比较
病毒:ssAAV1、2、5、8,LV
启动子:CMV
注射量:AAV:1011 VP;LV:1.5×107 IU
注射方法:胰腺导管给药
(Cheng, H., et al. J Biomed Sci, 2007.)
图2. 不同血清型AAV经胰腺局部给药后的组织分布
病毒:ssAAV1、2、5、8
启动子:CMV
注射量:1011 VP
注射方法:胰腺导管给药
(Cheng, H., et al. J Biomed Sci, 2007.)
图3. AAV1和AAV8对胰腺转导的剂量反应
病毒:ssAAV1、8
启动子:CMV
注射量:108-1011 VP
注射方法:胰腺导管给药
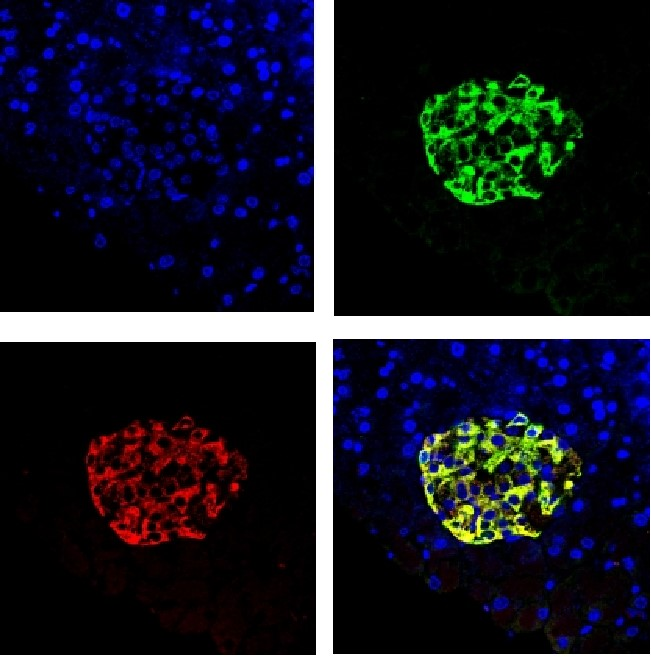
· 维真AAV8感染小鼠胰腺效果图 ·
(Insulin:红色荧光 GFP:绿色荧光)
病毒产品:AAV8-insulin-GFP
病毒用量:1012 vg
注射方法:胆总管(十二指肠壶腹开口处)
二、AAV载体的选择
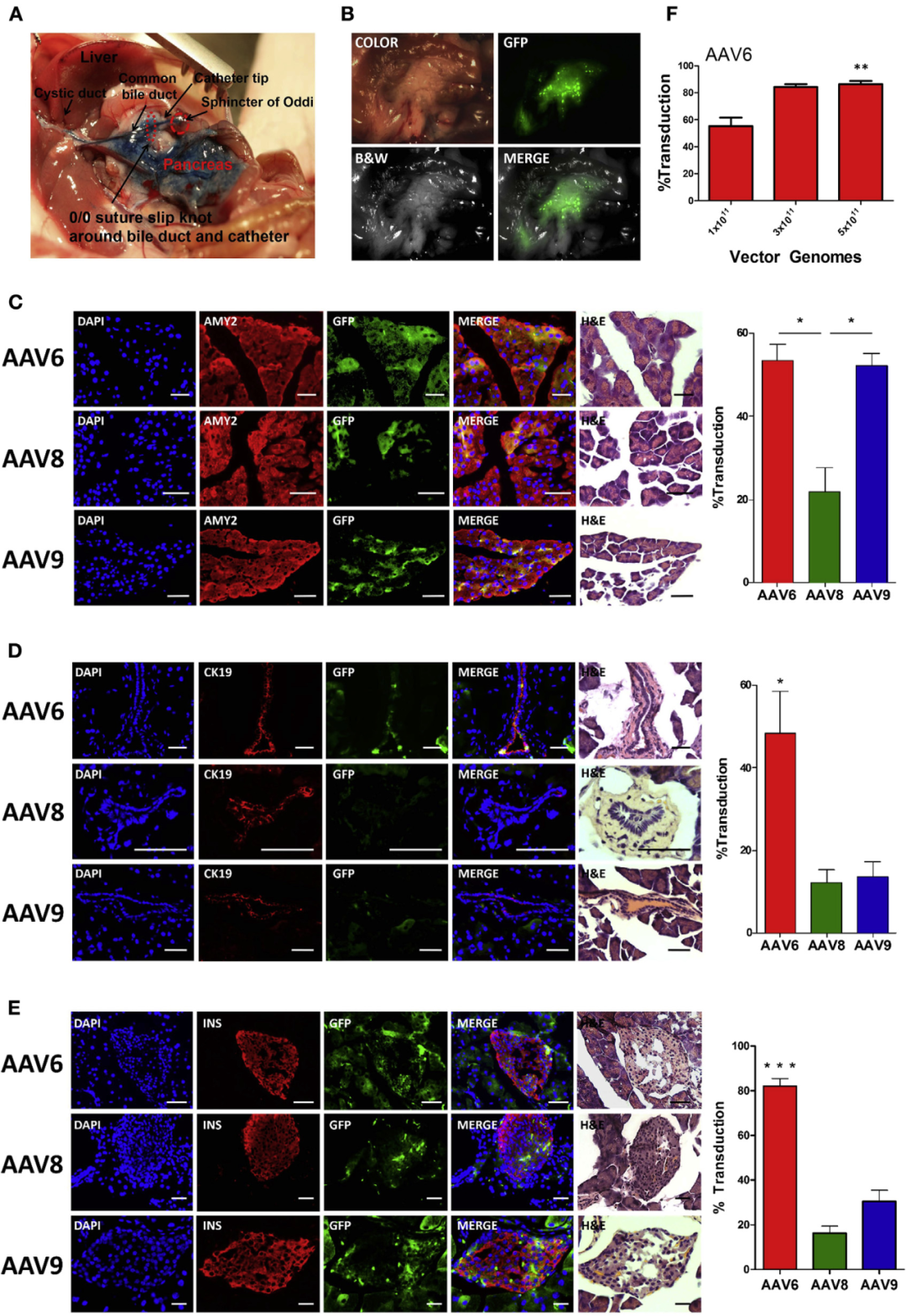
研究表明scAAV对胰腺的转导效率也较高,且不同血清型转导效率与给药方式、启动子和注射量等密切相关。体外感染分离的胰岛时,scAAV6的感染能力强于scAAV1、scAAV2和scAAV8;通过全身给药时(腹腔体内注射),scAAV8比scAAV6转导效率强(图5);而通过胰腺导管给药时,scAAV6强于scAAV8、9,可以有效转导腺泡、导管、胰岛在内的多种胰腺细胞(图6)。
图5.不同血清型dsAAV-CB-GFP载体对体外胰岛和体内胰腺的转导效率比较
病毒:scAAV1、2、5、6、8
启动子:CB
注射量:5×1011VG
注射方法:腹腔注射
(Wang, Z., et al. Diabetes, 2006.)
图6.胰腺导管给药时,scAAV6转导效率强于scAAV8、9
病毒:scAAV6、8、9
启动子:EF1α
注射量:1×1011VG
注射方法:胰腺导管给药
(Quirin, K.A., et al.Mol Ther Methods Clin Dev, 2018.)
三、启动子的选择
为了在胰腺特定细胞中实现AAV介导的转基因表达,可以选择胰腺组织特异性启动子,目前文献中推荐的启动子是胰腺β细胞特异性启动子Insulin和PDX1,可以有效介导基因在胰腺β细胞的特异表达。
四、注射方式的选择
在胰腺研究中,常用的给药方有腹腔注射、静脉注射和胰腺导管内注射。不同给药方式会影响AAV载体对细胞的转导能力。研究表明,与导管内给药相比,ssAAV8和ssAAV9载体对胰腺的系统性给药会导致其转导率降低.(参考文献“Safety and Efficacy of AAV Retrograde Pancreatic D)
因此,根据实验目的选择合适的注射方式十分重要。系统性给药方式(腹腔注射和静脉注射)的操作方式不再赘述,在此介绍一下胰腺导管内注射的操作方式(仅供参考):
1、将小鼠进行麻醉后手术打开其腹腔,在胆囊底部切一小口,将特定的导管插入胆囊管中;
2、将导管置入总胆管,并在胆管和导管周围用微钳夹固定,以防止载体反流进入肝脏;
3、将微钳夹置于Oddi括约肌上,避免载体漏入十二指肠,将100μl AAV载体通过导管缓慢注入胰管,腺体均匀肿胀则证明给药成功;
4、灌注5min后取下上述两个微钳夹;
5、取出导管,手术缝合小鼠腹腔伤口。
6、术后,将小鼠放置在加热垫上待其恢复后放回笼子。
· 总结 ·
在胰腺研究中,不同AAV血清型转导效率与AAV载体选择、启动子以及给药方式等因素密切相关:
①通过胰腺导管给药方式,ssAAV8比ssAAV1、ssAAV2、ssAAV5转导效率强;
②通过全身给药,scAAV8比scAAV6转导效率强;通过胰腺导管给药方式时,scAAV6强于scAAV8、9;
③ssAAV8、9经胰腺导管给药比经全身给药转导效率强。
小V建议您实验前根据实验目的综合选择合适的载体、血清型、启动子和注射方式,以实现基因的高效长久表达。
客户案例分享1
“Autotaxin signaling facilitates b cell dedifferentiation and dysfunction induced by Sirtuin 3 deficiency”(IF=6.448)
外周组织β细胞功能缺陷和胰岛素抵抗是2型糖尿病(T2D)的主要病理生理学特征。β细胞去分化是导致β细胞功能缺陷进而促进T2D进展的因素之一。研究表明,控制β细胞去分化可作为改善β细胞功能的一种潜在治疗策略。此外,多项研究证实胰岛中SIRT3蛋白的表达与β细胞功能障碍密切相关。
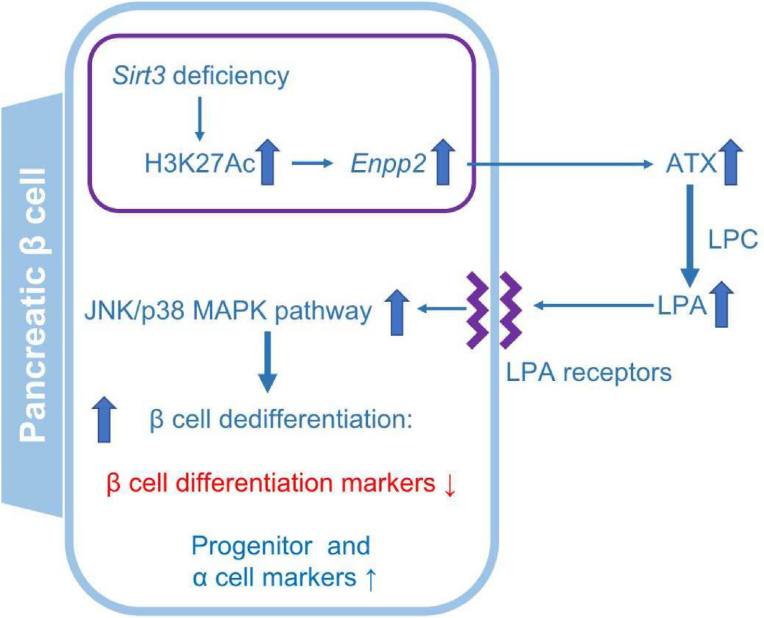
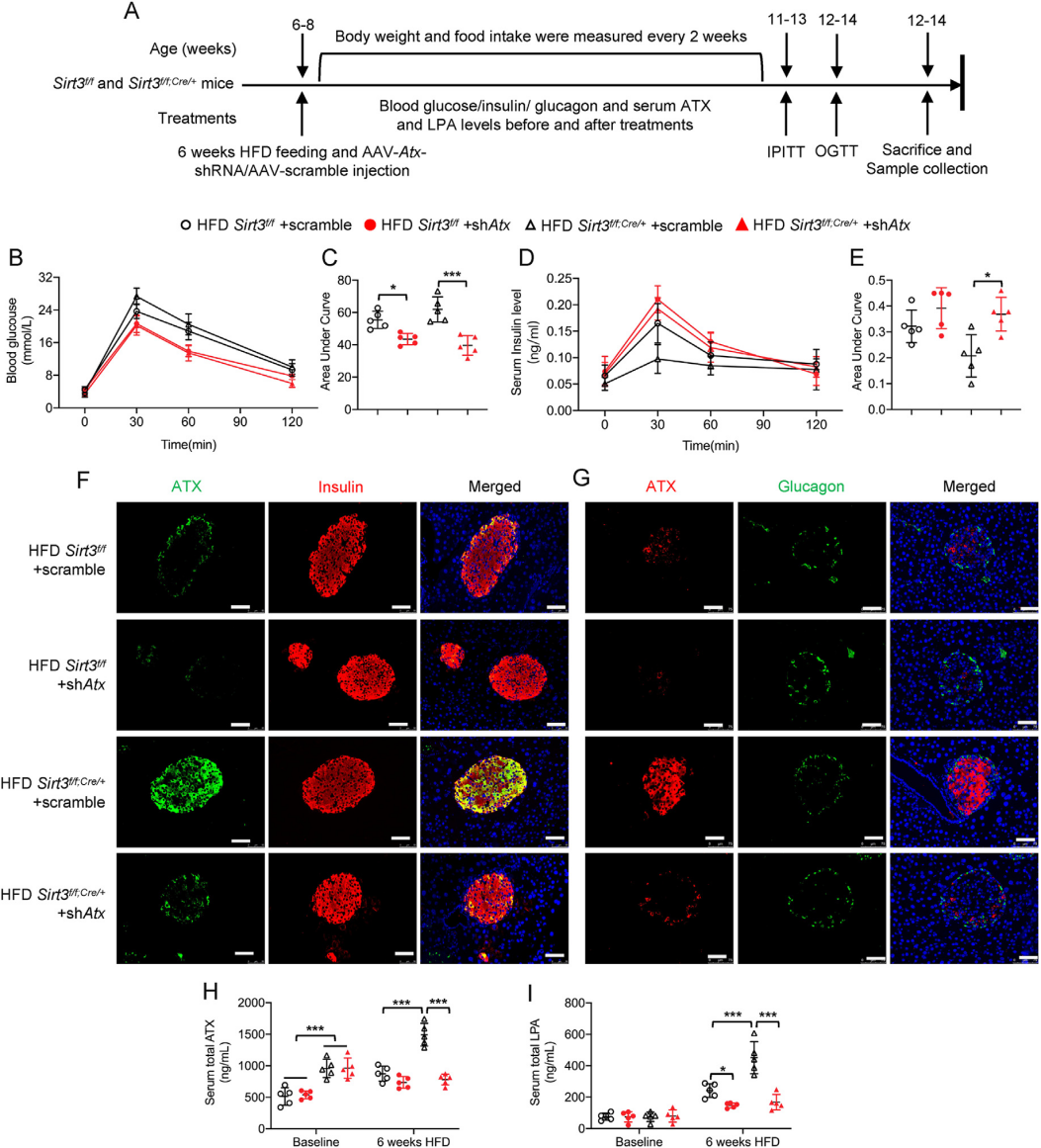
先前的研究已发现,β细胞Sirt3特异性敲除的小鼠在HFD喂食后,糖耐量和胰岛素分泌受损;胰岛Sirt3缺失后Enpp2(又称ATX)蛋白表达增强,Enpp2/ATX是一种具有溶血磷脂酶活性的分泌酶,可产生溶血磷脂酸(LPA)。在此研究中,作者假设ATX/LPA通路的激活促进了Sirt3缺陷β细胞的去分化,并将LPA或LPC(ATX可将其水解产生LPA)应用于Sirt3缺失的MIN6细胞系和小鼠胰岛,以研究LPA对β细胞去分化的影响及其潜在机制。
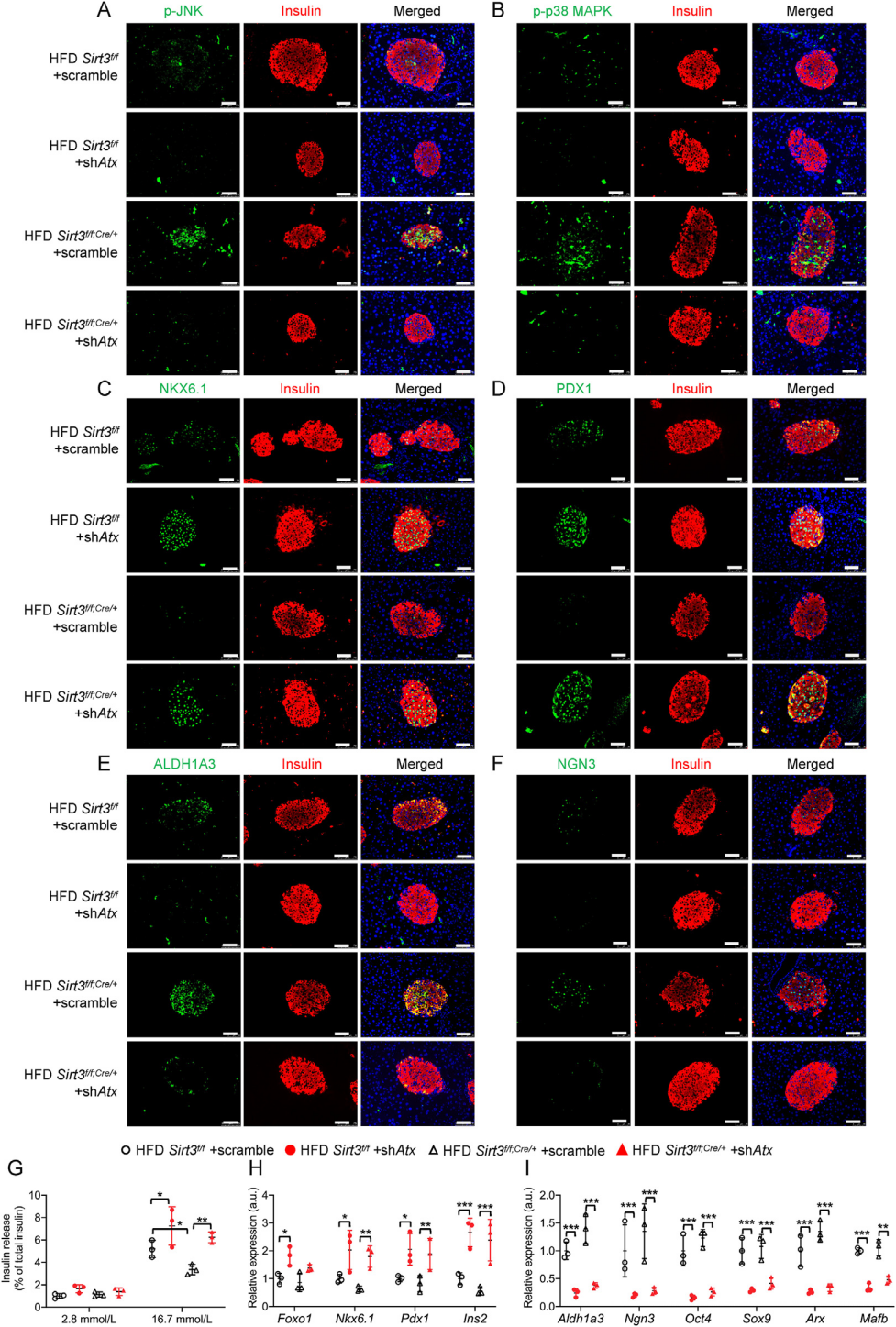
研究显示在Sirt3缺失的MIN6细胞和小鼠胰岛中,ATX表达上调导致LPC增加,进而使LPA产生增加。LPA的增加不仅诱导了MIN6细胞和小鼠胰岛的可逆去分化,而且还减少了葡萄糖刺激的胰岛素分泌。机制上,ATX/LPA通过诱导JNK/p38 MAPK磷酸化促进β细胞脱分化。使用AAV8体内抑制ATX(AAV8-Atx-shRNA)可以改善HFD喂养的Sirt3缺失小鼠的胰岛素分泌并减少β细胞的去分化。
图7. Sirt3-ATX/LPA通路在胰腺β细胞去分化中的作用机制
基因信息:Atx,外核苷酸焦磷酸酶/磷酸二酯酶蛋白家族成员
病毒产品:AAV8-Atx-shRNA、AAV8-scramble(insulin 1启动子)
实验动物:8周龄雄性小鼠
注射方式:腹腔注射
注射量:1×1012 genome copies
注射体积:100 μL
研究者使用腺相关病毒载体AAV8选择性抑制了ATX在正常小鼠和Sirt3 f/f;Cre/+小鼠胰岛中的表达。病毒注射8周后,进行6周的HFD喂食。胰岛ATX蛋白水平的降低证明了AAV8病毒的有效传递。随后的多项实验测试表明胰脏β细胞中ATX的敲低不仅可以挽救HFD诱导的葡萄糖耐受不良,恢复胰岛素的分泌,还减弱了HFD诱导的Sirt3 f/f;Cre/+小鼠中JNK/p38 MAPK信号的激活,抑制β细胞的去分化。这些结果证实了ATX在体内对β细胞去分化的病理作用。
图8. Sirt3 f/f;Cre/+小鼠ATX的特异性敲低改善了HFD诱导的葡萄糖耐受不良
图9. Sirt3 f/f;Cre/+小鼠ATX的特异性敲低改善了HFD诱导的β细胞去分化
案例分享2
“HRD1 an important player in pancreatic β-cell failure and therapeutic target for type 2 diabetic mice”(IF=9.461)
2型糖尿病(T2D)是一种以血糖持续升高为特征的慢性代谢性疾病,研究报道胰脏β细胞衰竭导致的胰岛素分泌不足与T2D的发生发展密切相关。HRD1 (HMG-CoA reductase degradation 1),是内质网应激相关E3泛素连接酶的代表,通过靶向并有效降解错误折叠的胰岛素原维持胰岛β细胞的功能,HRD1的缺失会导致胰岛素分泌(GSIS)受损。研究报道HRD1在 Akita糖尿病小鼠胰岛中表达上调。NCBI GEO数据库的基因组数据显示,T2D患者胰岛细胞HRD1 mRNA水平升高。然而,HRD1在胰岛β细胞中的特异性病理作用仍不明确。
大量的β细胞转录因子在成熟β细胞功能的维持中起着至关重要的作用,其中,转录因子v-maf 肌腱膜纤维肉瘤癌基因同源物A(MafA)仅在胰腺β细胞中表达,是β细胞形成和功能所需的关键因子。尽管泛素诱导的降解是糖尿病条件下β细胞中MafA减少的主要原因,但E3泛素连接酶在调节MafA活性中的具体作用仍有待探索。
在本研究中,研究者发现HRD1在T2D病人和T2D小鼠胰岛中过度表达。功能研究表明,β细胞HRD1的特异性过表达引发了胰岛素分泌受损,最终导致严重的高血糖;相反,在糖尿病模型中,HRD1基因的下调改善了血糖控制和反应。蛋白质组学分析表明HRD1与β细胞功能调控因子MafA可能存在相互作用。机制上,HRD1作为E3泛素连接酶,在糖尿病β细胞中靶向MafA的泛素化和降解,导致细胞质中MafA的积累,并降低其在细胞核中的生物功能,进一步导致β细胞功能障碍。本研究揭示了HRD1可作为2型糖尿病的治疗靶点,确立了靶向HRD1对T2D治疗的重要性。
基因信息:HRD1
病毒产品:AAV8-MIP–shHRD1–GFP、AAV8-MIP-HRD1-GFP、AAV8-GFP-control
病毒滴度:1012 GCP/mL
注射方式:胰腺导管内注射,6 μl/min
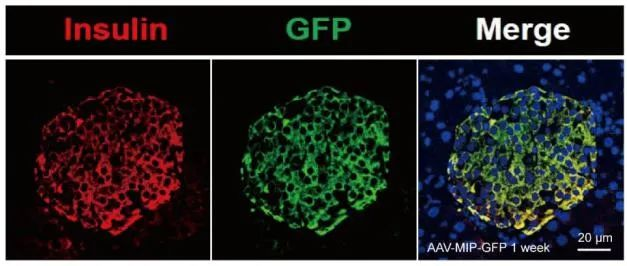
研究人员通过胰腺导管给药AAV8-MIP-shHRD1-GFP,注射入雄性C57BL / 6J小鼠胰腺导管,特异性敲低小鼠β细胞中的HRD1,免疫荧光证实了AAV载体在体内的有效传递(图10)。
图10. 胰腺导管给药AAV在体内的有效传递
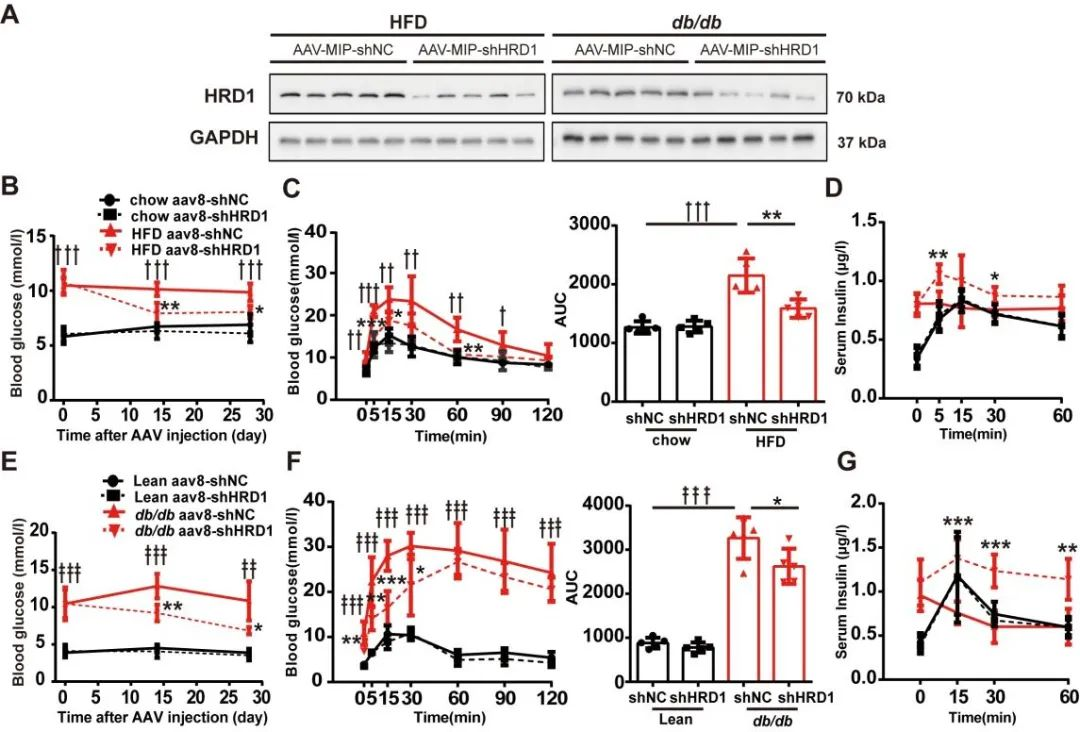
随后作者将AAV8-MIP-shHRD1注射入HFD饲喂的糖尿病小鼠胰腺导管,2周后,糖尿病小鼠空腹血糖明显下降。4周后,糖耐量试验(Intraperitoneal Glucose Tolerance Test,IPGTT)结果显示糖尿病小鼠血糖反应和血清胰岛素水平明显改善。AAV-shHRD1注射db/db小鼠的葡萄糖反应也有改善。综上结果表明HRD1在胰岛β细胞功能障碍和糖尿病中发挥重要作用。
图11. 抑制HRD1可改善糖尿病小鼠高血糖和葡萄糖耐受不良
研究人员通过胰腺导管内注射AAV8-MIP-HRD1,注射后胰岛HRD1蛋白水平明显升高,小鼠的空腹血糖和复餐血糖水平显著升高,获得β细胞HRD1特异性过表达小鼠。IPGTT结果显示糖代谢严重受损,HRD1特异性过表达的小鼠血浆胰岛素水平表现紊乱。上述结果表明β细胞HRD1上调可诱发高血糖并损伤胰岛素的分泌。
图12. HRD1过表达引发高血糖和葡萄糖耐受不良
案例分享 3
“Inhibition of miR-155 reduces impaired autophagy and improves prognosis in an experimental pancreatitis mouse model”(IF=8.469)
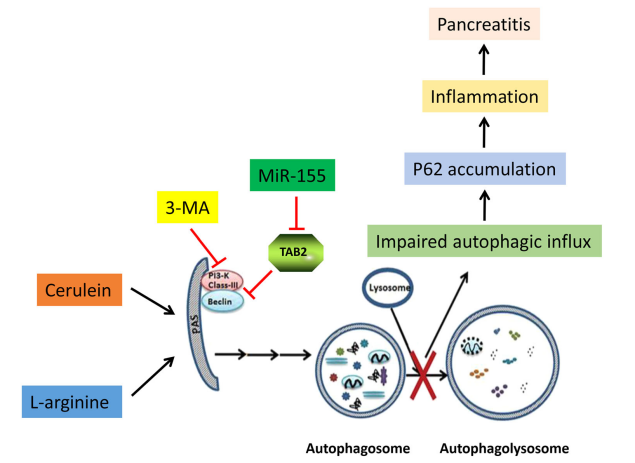
急性胰腺炎(AP)是一种胰腺炎症疾病,其特征是蛋白酶异常激活、实质损伤、胰腺自消化、腺泡细胞凋亡和坏死以及强烈的炎症反应。AP的早期阶段,胰腺的损伤和炎症会引起全身炎症反应综合征(SIRS),可导致单个或多个器官衰竭,这也正是AP早期发病和死亡的主要原因。然而,AP引起的器官衰竭的病理机制还尚未阐明。
MiR-155是一种在炎症反应促进和抗炎通路激活抑制中发挥重要作用的miRNA,已有研究表明,miR155在胰腺炎样本中表达上调。已知自噬受损可促进酶原激活、腺泡细胞分泌异常、细胞死亡和炎症反应进而加重AP;此外,有研究表明miR-155在多种疾病中促进自噬。本研究旨在通过调节自噬探究miR-155对AP病程的影响。
基因信息:miR-155
病毒产品:AAV9-miR-155、AAV9-miR-155 sponge
注射体积:病毒稀释液50 μL
注射方式:尾静脉注射
检测时间:注射3周后
首先,本研究构建了AP小鼠模型,利用AAV9载体介导miR-155和miR-155 sponge在AP小鼠胰腺中进行有效传递,发现miR-155靶蛋白TAB2的表达受到明显调控。此外,miR-155表达的调节可以影响蛙皮素诱导的AP严重程度,进一步研究发现沉默miR-155可以抑制不能与溶酶体融合的自噬小体的积累,并通过靶向TAB2减少胰腺炎症,从而改善AP模型小鼠的胰腺和肺损伤。此外,自噬抑制剂3-MA可以减少自噬小体的异常积累,从而减轻因miR-155水平升高而加重的胰腺损伤。本研究表明调节miR-155的表达可能是治疗或预防胰腺炎的一种潜在策略。
图13. AP中miR-155和自噬的调节机制
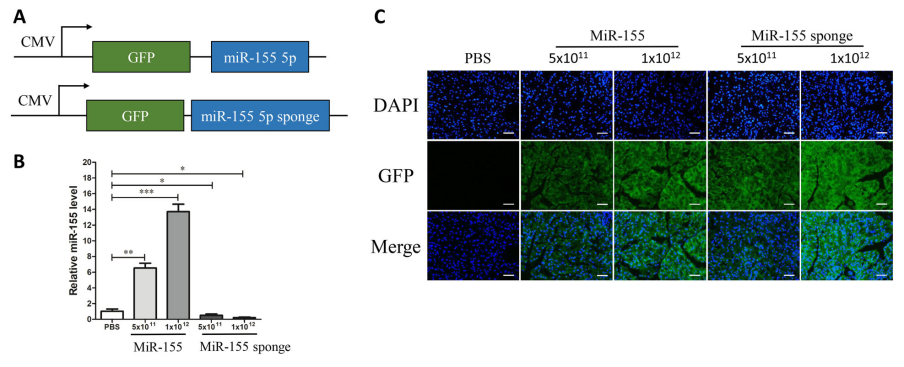
研究者通过小鼠尾静脉注射AAV介导的miR-155和miR-155 sponge,3周后检测miR-155的表达量,发现AAV9介导的miR-155在胰腺中有效传递,并且高滴度的AAV9对miR-155的表达影响更为显著(图14)。
图14. AAV9介导的miR-155在胰腺中有效传递
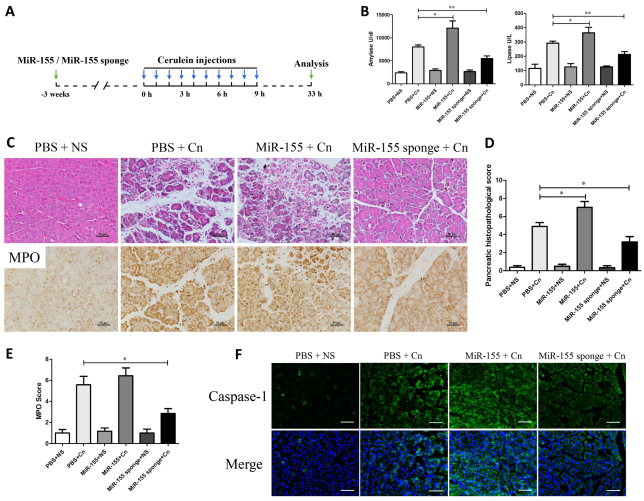
进一步研究miR-155的调控对蛙皮素诱导的AP程度影响,通过胰腺水肿、炎症细胞浸润、腺泡细胞的病理改变以及淀粉酶和脂肪酶水平,发现上调miR-155可以加重蛙皮素诱导的AP严重程度,而下调miR-155可能对实验性胰腺炎具有保护作用。
图15. miR-155表达的调控影响蛙皮素诱导的AP严重程度
 当前位置:首页 > 研究领域 > 消化系统
当前位置:首页 > 研究领域 > 消化系统