『AAV-骨骼系统』如何实现外源基因在骨骼系统的高效表达?
骨骼存在于人和动物体内,为肌肉、肌腱和韧带提供了附着点,从而使运动成为可能。骨骼细胞谱系涵盖了在稳态和损伤期间分别维持和修复骨骼的多种细胞,包括成骨细胞、骨细胞和软骨细胞,这些骨骼细胞类型主要参与骨骼和软骨的形成,而负责骨骼吸收的破骨细胞则来自造血谱系。通过成骨细胞和破骨细胞活性之间的平衡来维持正常的骨稳态。骨骼系统通过其支撑身体、保护内脏器官、参与运动功能、造血功能以及调节矿物质平衡等主要作用来维持身体健康,但由于多种因素的相互作用,机体功能易出现退化,容易导致骨骼疾病的发生,对人们的生活造成诸多困扰。
AAV凭借安全性高、免疫原性低、宿主范围广及表达稳定等特点,被视为最有前途的基因转移载体之一,目前已被广泛应用于多种疾病的基因治疗。本期我们将和大家一起学习AAV在骨骼系统中的应用方法。

温馨提示:以上来自于文献报道,AAV在骨骼系统中的转导效率应结合血清型、启动子及注射方式等多方面综合考虑,建议在进行实验前根据具体想要感染的组织细胞查阅相关文献并进行预实验的摸索。
一. AAV血清型
案例 1
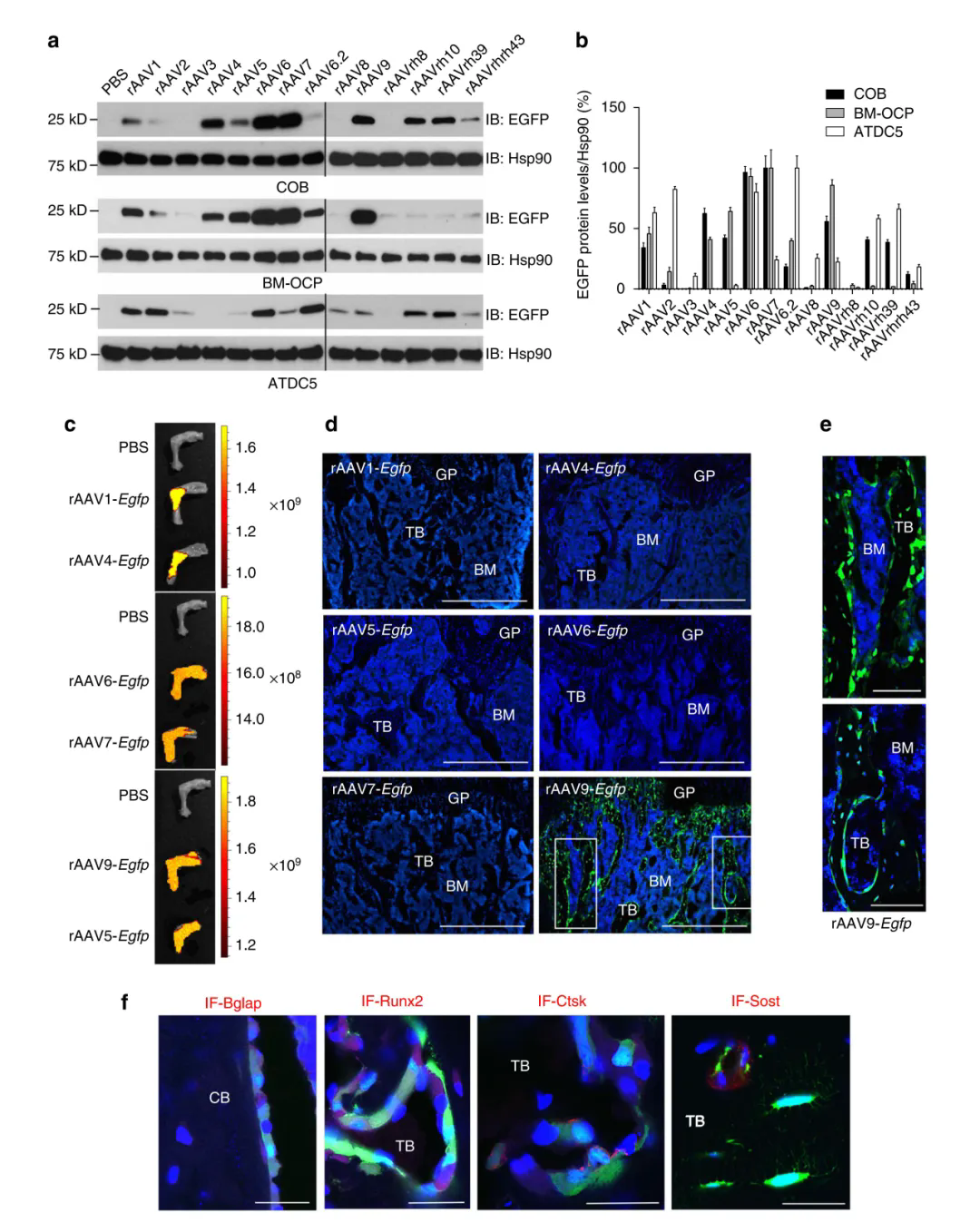
研究团队评估了在体外不同AAV血清型对小鼠颅骨成骨细胞(COB)、骨髓衍生的破骨细胞前体(BM-OCP)和软骨细胞祖细胞(ATDC5)的转导效率,发现rAAV1,rAAV4,rAAV5,rAAV6,rAAV7,rAAV9,rAAVrh.10和rAAVrh.39这八种AAV载体能够高效转导COB。其中,rAAV1,rAAV4,rAAV5,rAAV6,rAAV7和rAAV9也能转导BM-OCP,而rAAV1,rAAV6,rAAVrh.10和rAAVrh.39则能转导ATDC5;此外,rAAV2和rAAV6.2实现了ATDC5细胞的有效转导,但在COB中转导效果较差。接着,将体外筛选出的八种血清型AAV通过关节腔注射到2月龄小鼠体内,发现仅AAV9能够有效转导成骨细胞、破骨细胞和骨细胞等。
(Yang YS, et al. Nat Commun.2019)
案例 2
通过膝关节注射不同AAV血清型(AAV1, 2, 3, 4, 5, 6, 7, 8, 9, 6.2, rh8, rh10, rh39, rh43)至不同样本软骨组织中,发现与其他AAV血清型相比,AAV2和AAV6.2在体内外软骨细胞的基因递送中均表现出很高的转导效率。
不同AAV血清型在小鼠软骨组织中的转导效率比较
(Dong Suk Yoon,et al. Int. J. Med. Sci. 2021)
二. 启动子
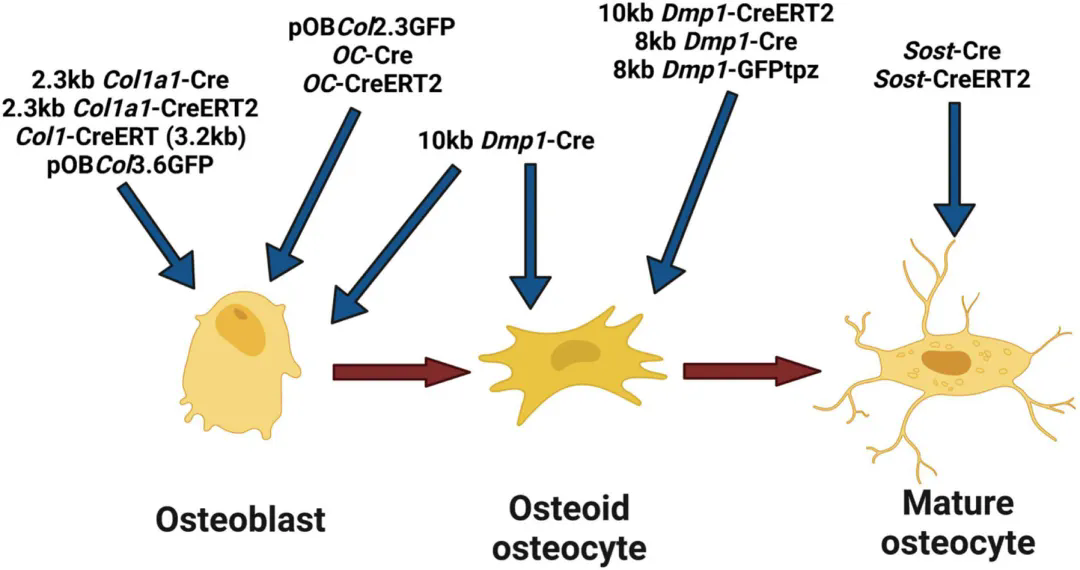
为增强AAV对骨骼系统的特异性靶向,除了可以选择CMV等广谱启动子外,还有多种骨骼特异性启动子:
体内用于靶向成骨细胞和骨细胞的启动子概述
(Kitase Y, Prideaux M. Bone. 2023)
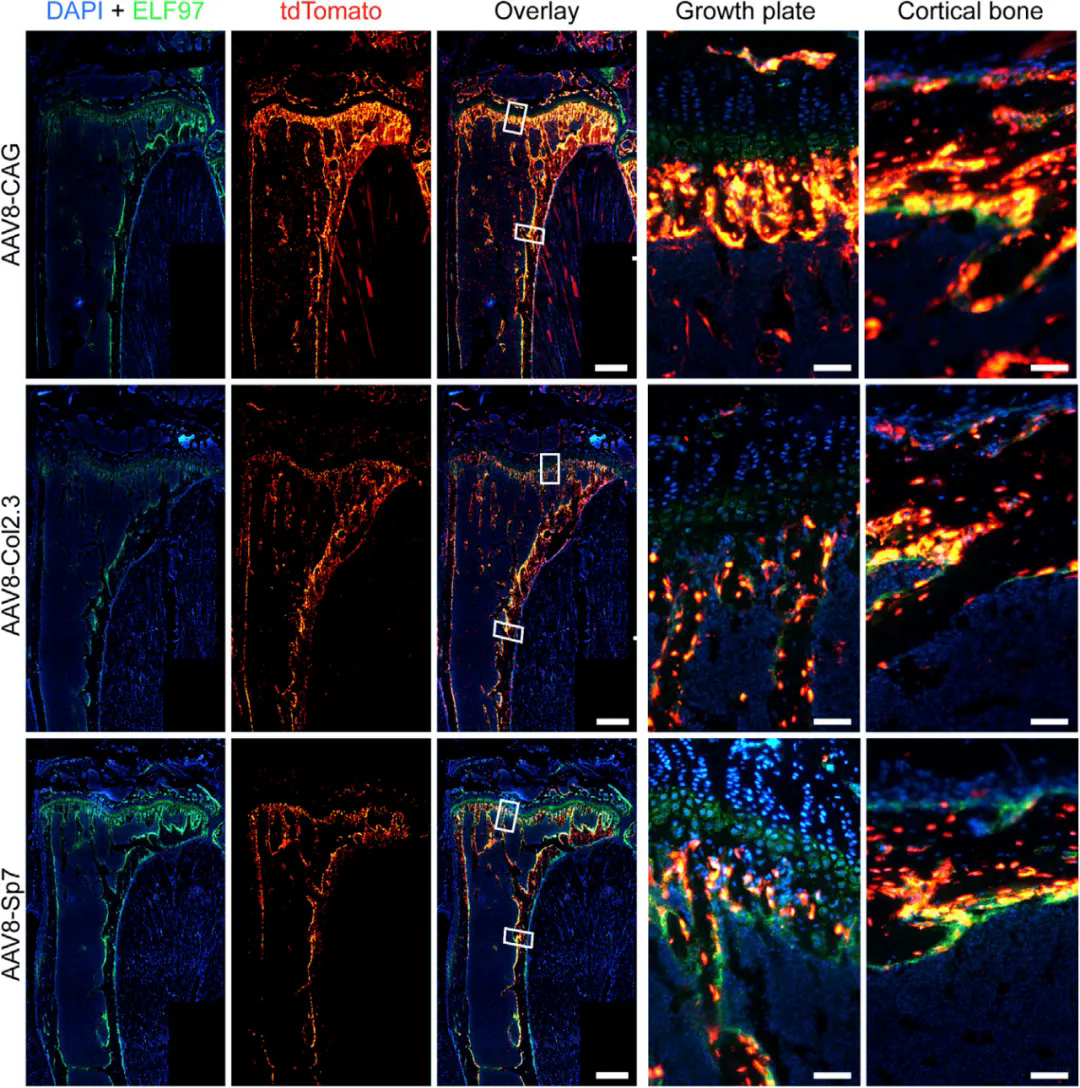
在CAG、Col2.3和Sp7三种启动子的驱动下,将AAV8-tdTomato(5×1011vg)经尾静脉注射至小鼠体内,检测发现三种构建体均成功转导胫骨细胞;值得注意的是,骨特异性启动子Col2.3和Sp7驱动的tdTomato表达与成骨细胞标记物AP共定位且转导水平相似。其中Col2.3介导骨膜和成骨细胞的转导,而Sp7主要介导成骨细胞的转导。
全身给药后,携带骨细胞特异性启动子的AAV8选择性靶向成骨细胞
( Lee, Lucinda R. , et al. Methods, Clinical Development. 2019)
三. 注射方式
针对骨骼系统的AAV注射方式可分为三种:针对骨骼系统特异性的骨关节腔注射、静脉注射以及针对骨髓的骨内注射。关节腔注射(Intra-Articular Injection)是首选的给药方法。与全身给药相比,关节内注射降低了非靶器官发生不良事件的可能性,提高了治疗药物在关节腔内的有效浓度,并且降低了成本。通过该注射方式给药AAV可以将基因高效的传递至关节,滑膜中的成纤维样滑膜细胞(FLS)、巨噬细胞、树突状细胞、B细胞和T细胞等均可被有效转导。
操作步骤(以膝关节注射为例):
1) 抓握固定小鼠,对膝关节作备皮处理;
2) 用75%乙醇消毒后,握紧小鼠下肢,屈曲60°;
3) 取微量注射器于髌骨下方腱外缘进针,稍向内下穿过关节囊后即感到有落空感,此时不再进针并缓慢注射,注射完毕后静置10s;
4) 旋转拔出注射器,对注射位置作75%乙醇消毒处理。
小鼠膝关节注射示意图
(https://www.clodrosome.com/animal-injection/)
四. 客户案例
骨关节炎 / 案例1
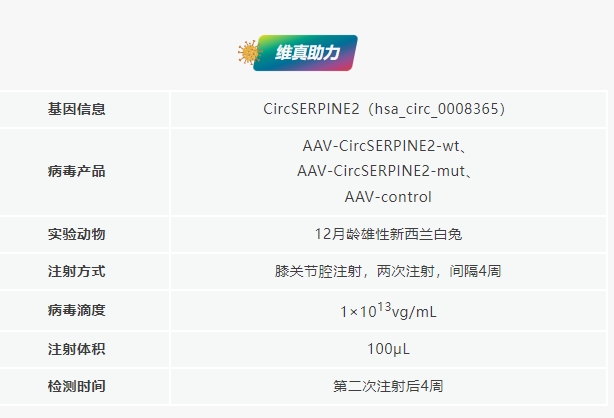
文章标题:CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS-related gene
发表期刊:Annals of the Rheumatic Diseases (IF 27.973)
合作客户:浙江大学医学院附属邵逸夫医院范顺武教授团队

CircSERPINE2过表达可缓解OA兔的症状
研究团队将AAV-CircSERPINE2-wt或AAV-CircSERPINE2-mut通过关节内注射入前交叉韧带横切(ACLT)诱导的OA兔体内。结果显示OA兔在注射AAV-CircSERPINE2-wt后软骨表面得到了改善,AAV-CircSERPINE2-mut组则无改善。OARSI评分显示,AAV-CircSERPINE2-wt显著降低了OARSI评分,而AAV-CircSERPINE2-mut则提高了OARSI评分;显微CT图像显示OA兔骨赘增加,注射AAV-CircSERPINE2后骨赘减少。免疫组化和WB分析显示,注射AAV-CircSERPINE2-wt减轻兔OA模型软骨基质的退行性变化,如细胞凋亡增强和分解代谢反应增强,ECM组成增加。
骨关节炎 / 案例2
文章标题:IRF1 regulation of ZBP1 links mitochondrial DNA and chondrocyte damage in osteoarthritis
发表期刊:Cell Communication and Signaling (IF 8.2)
合作客户:华中科技大学同济医学院附属同济医院祝文涛教授团队
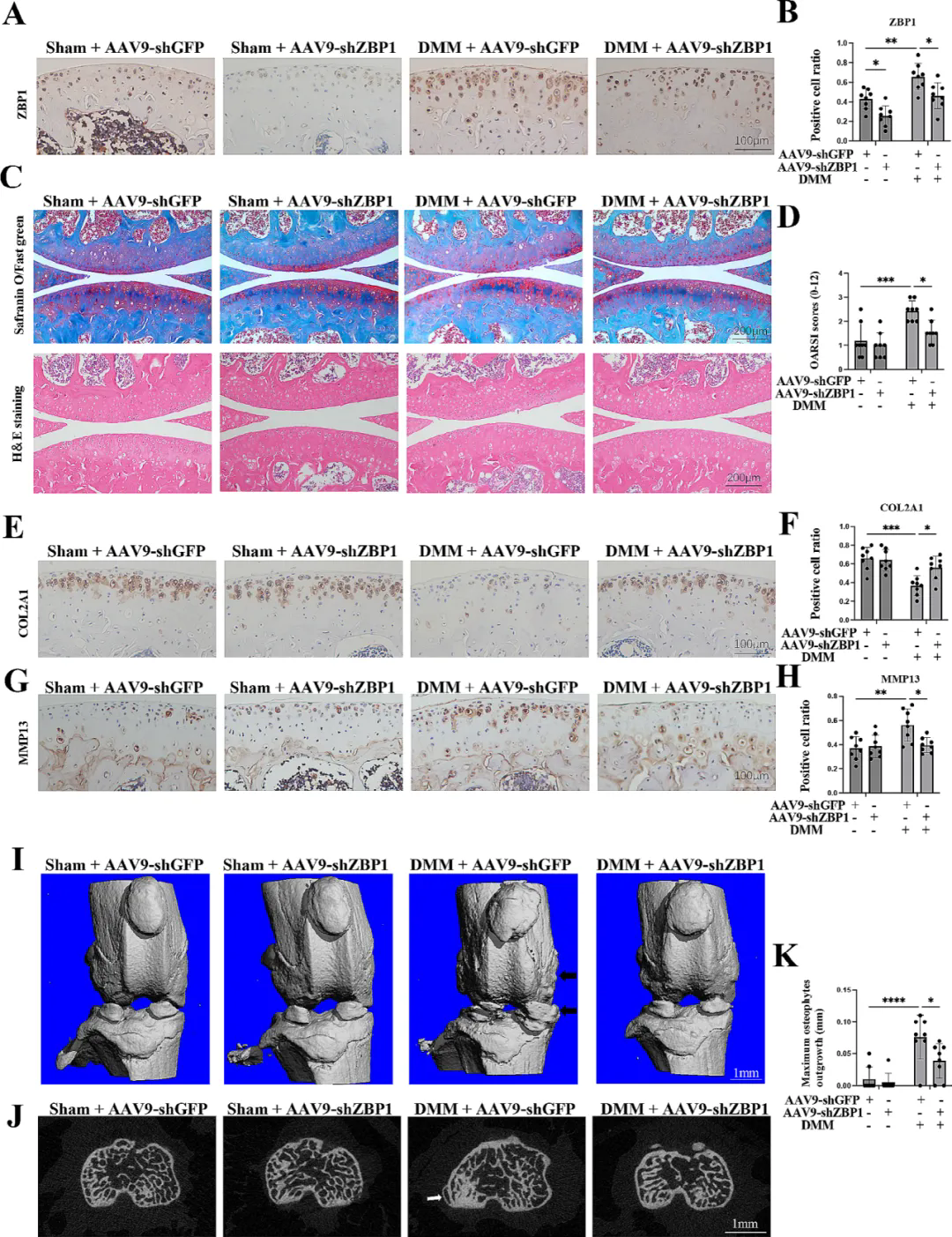
ZBP1对DMM小鼠的OA进展至关重要
为评估软骨细胞中ZBP1的缺失是否能保护小鼠免受OA侵害,研究团队将AAV9-shZBP1注射到小鼠膝关节腔内,IHC结果证实,与AAV9-shGFP组相比,AAV9-shZBP1有效减少了ZBP1-软骨细胞数量。在首次注射AAV9两周后,进行DMM手术或假手术,并在术后第56天处死小鼠。与DMM组相比,AAV9-shZBP1组小鼠关节软骨退化较少,OARSI评分较低。通过评估四组软骨下骨和骨赘的变化,发现接受DMM手术的AAV9-shZBP1注射小鼠骨赘形成减少,骨赘评分降低。上述结果表明,软骨中ZBP1的下调保护了小鼠免受DMM诱导的软骨退化和骨赘形成的影响。
骨关节炎 / 案例3
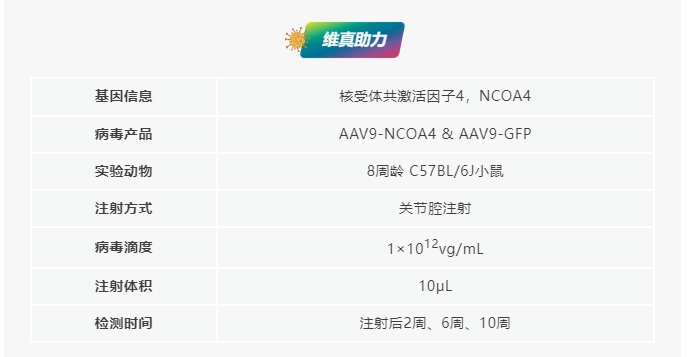
文章标题:JNK-JUN-NCOA4 axis contributes to chondrocyte ferroptosis and aggravates osteoarthritis via ferritinophagy
发表期刊:Free Radical Biology and Medicine (IF 8.101)
合作客户:华中科技大学同济医学院附属同济医院郭风劲教授团队
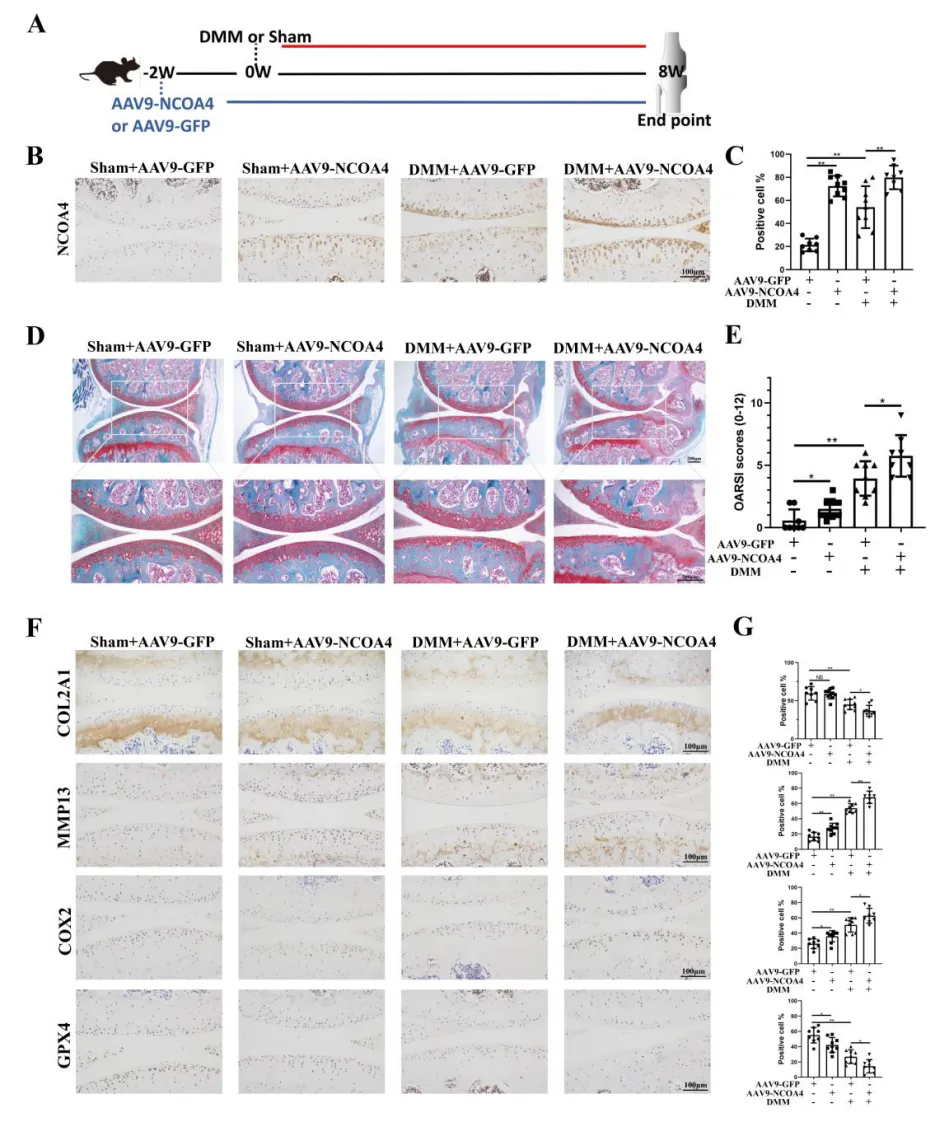
NCOA4过表达加剧小鼠创伤后骨关节炎的软骨退变
研究团队将AAV9-NCOA4注射到小鼠关节腔中,实现NCOA4在软骨中的过表达。两周后,对小鼠进行DMM手术或假手术。DMM手术小鼠发生了软骨退变,表现为蛋白聚糖损失和软骨糜烂。值得注意的是,与DMM组相比,AAV9-NCOA4注射小鼠更容易发生DMM引起的退变,其特点是OARSI评分更高。DMM手术后AAV9-NCOA4处理的小鼠出现了更大的骨赘,骨赘评分更高。以上结果表明,NCOA4在软骨中的过表达加速了创伤后骨关节炎小鼠的软骨退变和骨赘的形成。
骨关节炎 / 案例4
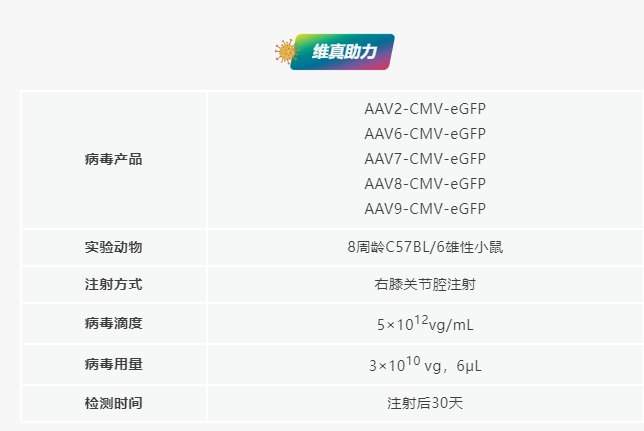
文章标题:Comparative intra-articular gene transfer of seven adeno-associated virus serotypes reveals that AAV2 mediates the most efficient transduction to mouse arthritic chondrocytes
发表期刊:PLOS ONE (IF 2.9)
合作客户:浙江中医药大学阮红峰/吴承亮/杜伟斌研究团队
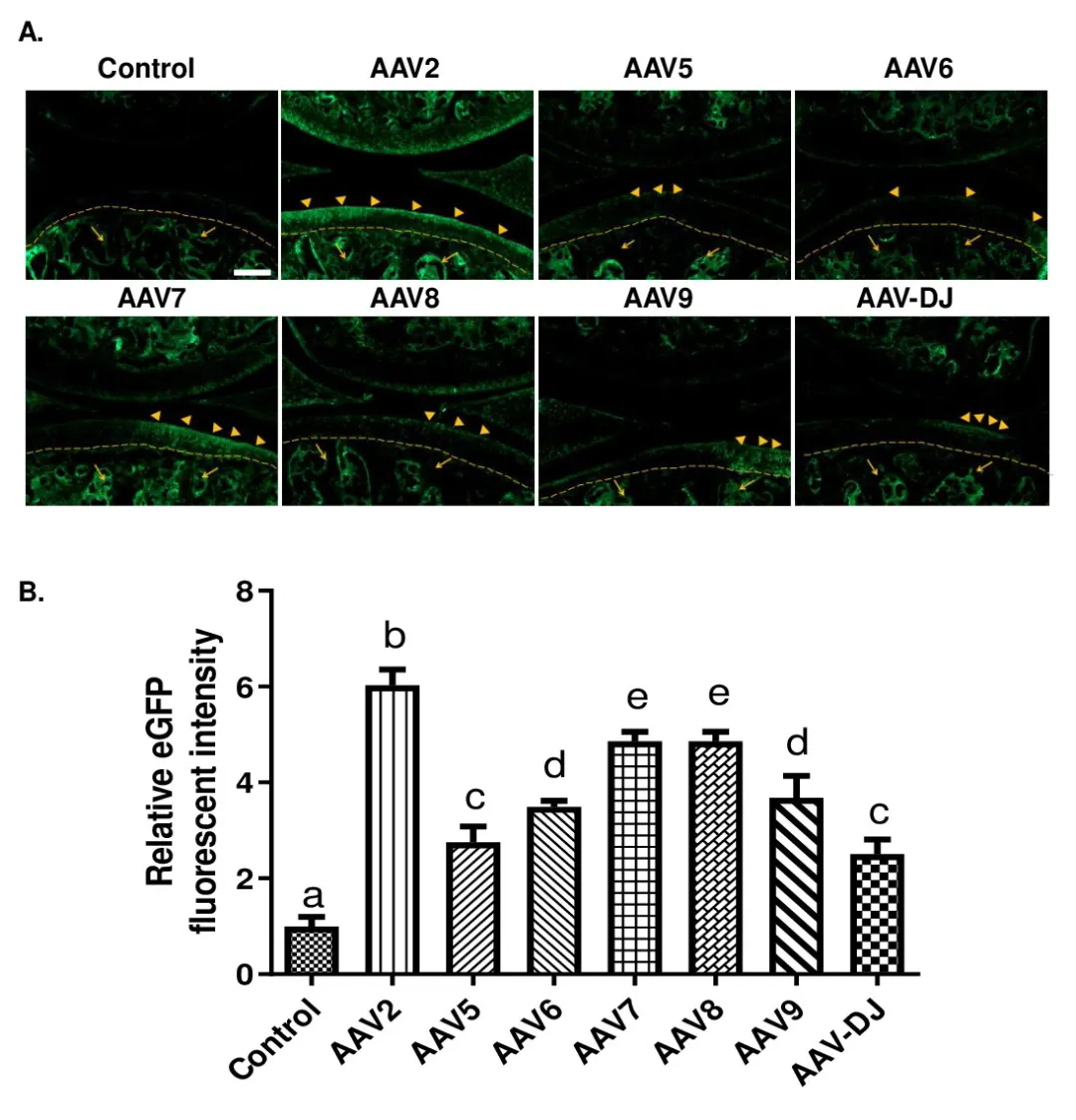
经关节内注射不同血清型AAV在软骨组织中的表达
为比较七种常用的AAV血清型(AAV 2、5、6、7、8、9和AAV-DJ)在体内对关节软骨的趋性和转导效率,研究团队将等体积的不同AAV血清类型注射到小鼠膝关节腔内。检测发现,eGFP在所有注射AAV的小鼠的关节软骨、滑膜和半月板中都有特异性表达;与AAV5/6/7/8/9/DJ血清型相比,关节内注射AAV2对小鼠膝关节软骨组织感染效率更高且特异性更强。
五. 参考文献
1. Evans CH, Ghivizzani SC, Robbins PD. Gene Delivery to Joints by Intra-Articular Injection. Hum Gene Ther. 2018 Jan;29(1):2-14.
2. Adriaansen J, Vervoordeldonk MJ, Tak PP. Gene therapy as a therapeutic approach for the treatment of rheumatoid arthritis: innovative vectors and therapeutic genes. Rheumatology (Oxford). 2006 Jun;45(6):656-68.
3. Kitase Y, Prideaux M. Targeting osteocytes vs osteoblasts. Bone. 2023 May;170:116724.
4. Yang YS, et al. Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis. Nat Commun. 2019 Jul 4;10(1):2958.
5. Dong Suk Yoon,et al.Cellular and Tissue Selectivity of AAV Serotypes for Gene Delivery to Chondrocytes and Cartilage. Int. J. Med. Sci. 2021.Jul 25;18(15):3353-3360.
6. Shen S, et al. CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS-related gene. Ann Rheum Dis. 2019 Jun;78(6):826-836.
7. Sun K, et al. IRF1 regulation of ZBP1 links mitochondrial DNA and chondrocyte damage in osteoarthritis.Cell Communication and Signaling.2024. 22:366.
8. Sun K, et al. JNK-JUN-NCOA4 axis contributes to chondrocyte ferroptosis and aggravates osteoarthritis via ferritinophagy. Free Radic Biol Med. 2023 May 1;200:87-101.
9. Chen Q, et al. Comparative intra-articular gene transfer of seven adeno-associated virus serotypes reveals that AAV2 mediates the most efficient transduction to mouse arthritic chondrocytes. PLoS One. 2020 Dec 15;15(12):e0243359.
 当前位置:首页 > 研究领域 > 其他
当前位置:首页 > 研究领域 > 其他