 当前位置:首页 > 研究领域 > 其他
当前位置:首页 > 研究领域 > 其他
肾脏疾病已成为威胁人类健康的主要疾病之一,全球约有13%人口受其影响。已知由基因突变引起的慢性肾脏疾病的发病率可高达千分之一,近80种基因的突变都与各种遗传性肾脏疾病有关。然而,由于肾脏结构和功能的复杂性,针对肾脏疾病的基因治疗的研究和开发滞后于肝脏、神经肌肉和眼睛等。自20世纪90年代末以来,研究人员已经开始利用AAV进行体内外肾脏的基因传递研究,并取得一定的成果,然而所带来的实际转导效果存在很大程度的不同,这可能与不同的传递方式以及不同的AAV血清型等因素有关。如何实现或者更大程度上实现外源基因在肾脏中的转导成为影响肾脏基因治疗发展的关键。
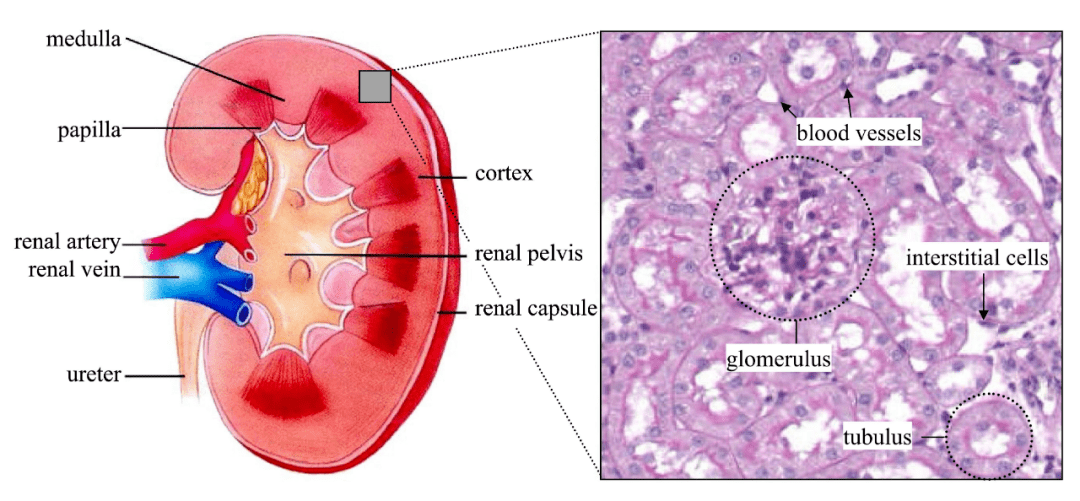
给药途径的选择是基因治疗有效性的重要决定因素。哺乳动物的肾脏具有严格的过滤功能,排斥大于50kDa的蛋白质,此外,肾小球内的足细胞形成直径仅为10nm的狭缝横膈膜,传统的AAV载体全身给药难以在肾脏达到足够的表达水平,即便是高剂量给药也会导致AAV集中在肝脏等肾外器官中。为了提高病毒载体对肾脏的转导并降低病毒载体对肾外器官的转导效率,除了全身给药方式外,近年来,科学家陆续开发了肾脏局部给药途径包括肾动脉注射、肾静脉注射、经肾实质注射、经输尿管逆行给药和经肾实质肾盂注射等(图2)。
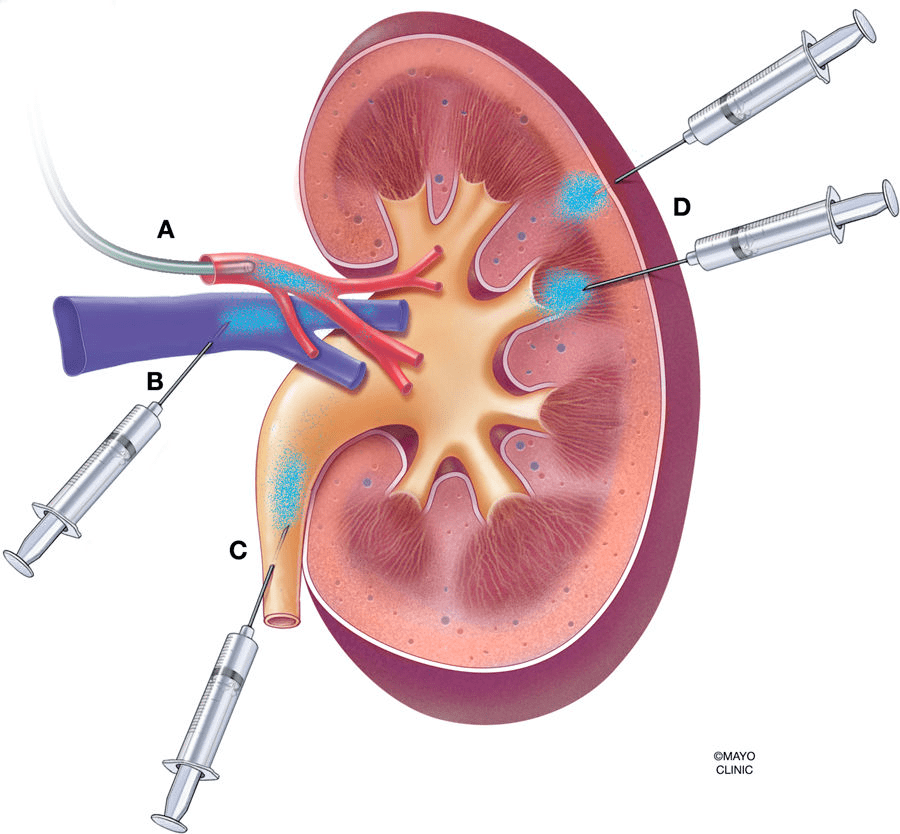
如下表所列,这些以手术为基础的AAV给药方法实现了外源基因在肾脏中不同分布模式,且具有不同的特点。
| AAV肾脏给药方式 | 基因表达分布 | 特点 |
|---|---|---|
| 肾静脉注射 | 皮质和髓质中表达,主要在肾小球和近端小管中 | 难以突破肾小球屏障,效率较低 |
| 肾动脉注射 | 近端小管和肾集合管 | 技术挑战性强 |
| 肾实质注射 | 仅限于注射针道周围 | 操作相对简单 |
| 经输尿管肾盂逆行注射 | 肾脏管道系统 | 克服肾小球屏障限制,操作难度大 |
| 经肾实质肾盂注射 | 皮质和髓质的肾小管上皮细胞中,主要是集合管细胞 | 新注射方式,操作简单,基因表达稳定 |
下面对肾静脉注射、经输尿管逆行注射和经肾实质肾盂注射三种注射方式进行简单分享:
①对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
②给小鼠左腹剃毛,在小鼠左腹部做一个切口,暴露左肾及肾蒂,并将肾静脉从肾蒂中游离;
③用显微止血夹夹住肾静脉远端以阻止病毒原液流出肾脏;
④用30G注射针刺入左肾静脉近端,将50µL液体(含有 5x1010个病毒颗粒基因组拷贝数或 PBS)注入肾静脉;
⑤5min后,拔出注射针,移去显微止血夹并压迫止血片刻,将切口分两层缝合。
①对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
②在小鼠左腹部做一个切口并轻轻剖开,找到输尿管远端和肾动脉并用显微止血夹夹住;
③用 30G注射针刺破输尿管,将注射针贴合于管壁并固定到位,使用 6-0缝线缝合以防液体泄漏;
④将尿液轻轻吸出,将注射器替换为另一个含有约 50µL液体(含有 5x1010个病毒颗粒基因组拷贝数或PBS)的注射器,并缓慢地将液体逆行注入输尿管;
⑤将注射针撤出,并在注射部位的近端放置一个显微止血夹以防液体泄漏;
⑥5min后,移去输尿管远端、近端及肾动脉上的显微止血夹,用6-0缝线将切口分两层缝合。
①对C57BL/6 小鼠(4-6 周龄,15-20g)进行麻醉手术,并使小鼠呈仰卧姿势于操作台上;
②对小鼠左腹进行剃毛处理,切开一个2cm的切口暴露左肾和输尿管,并将周围器官和脂肪轻轻分开;
③用显微止血夹夹住输尿管上段以阻止病毒原液下流至膀胱;
④用30G注射针刺入左肾中极的肾盂(注意注射针头不应刺穿肾盂),将50µL液体(含5x1010个病毒颗粒基因组拷贝数或PBS)注入肾盂;
注:注射针刺入肾盂而不刺穿肾盂的关键在于注意比对穿刺针和小鼠肾脏,并且在注射针上做好标记;
⑤5min后移去显微止血夹,将切口分两层缝合。
肾脏研究中常用的AAV载体有 AAV2、AAV6、AAV8 和AAV9,其中以AAV9型居多。
1. 在肾脏的尾静脉注射转导中,rAAV8和rAAV9的肾脏转导效率和转录活性优于rAAV2,rAAV9更优。
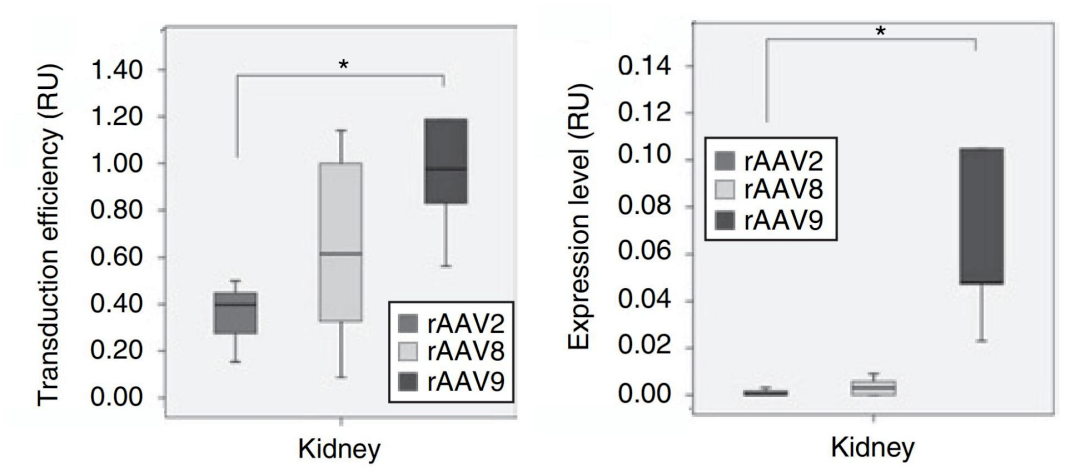
实验动物:6周龄雄性129/Sv小鼠
注射方式:尾静脉注射
注射量:5×1011vg
启动子:CMV
数据来源于:Combined Paracrine and Endocrine AAV9-mediated Expression of Hepatocyte Growth Factor for the Treatment of Renal Fibrosis.
2. Rocca et al. 利用肾静脉逆行注射技术将AAV5, AAV6, AAV8以及AAV9注入小鼠肾脏,不仅证实肾静脉逆行注射比尾静脉注射有更好的肾基因转导效果,而且发现在四种AAV血清型中,AAV9更能同时高效转导皮质和髓质(AAV6转导髓质效果更好,但对皮质转导效率较低),此外,AAV9均能有效靶向肾小球和近端小管且在肾小球内效率更高(图4)。
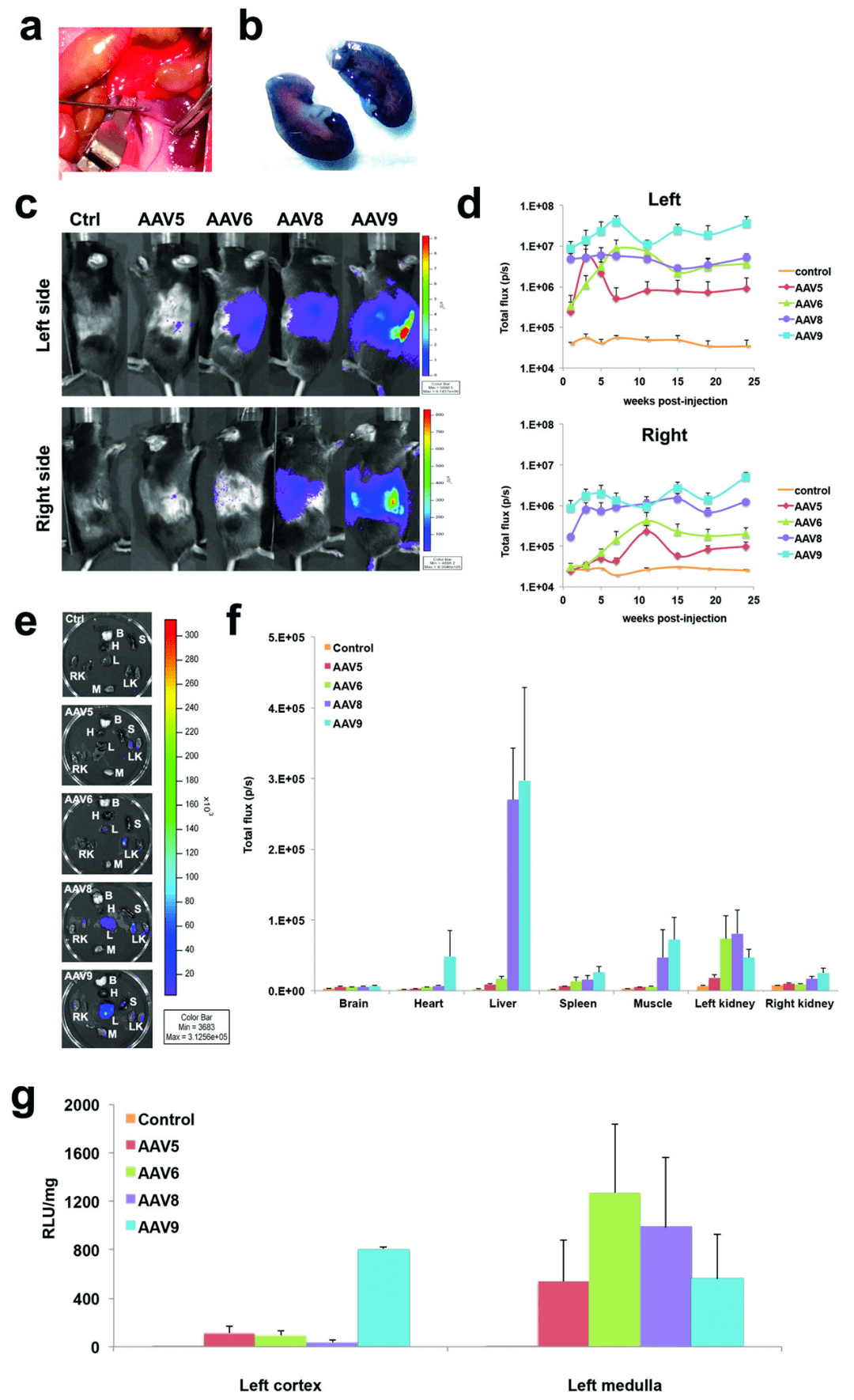
实验动物:2月龄C57BL/6小鼠
注射方式:肾静脉注射
注射量:100 µL,5×1010 particles
启动子:CMV
数据来源于:rAAV9 combined with renal vein injection is optimal for kidneytargeted gene delivery: conclusion of a comparative study.
以小鼠为例,一般情况下,AAV在肾脏中的给药剂量通常在10E10-10E11VG/只(需要根据注射方式灵活调整),根据病毒实际滴度,注射体积在50-100µL左右。
肾脏研究中可以选择广谱性启动子CMV,也可以选择特异性启动子NPHS1,增加肾脏靶向性。
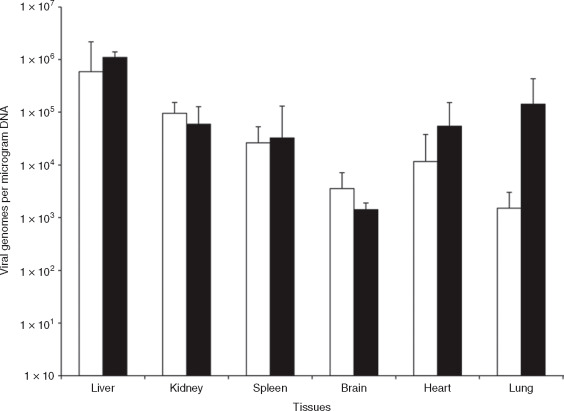
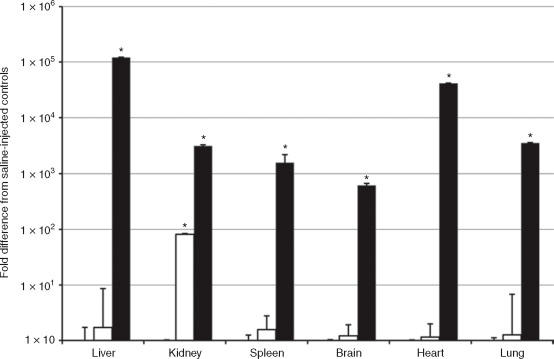
实验动物:17周龄C57BL/6怀孕母鼠;
注射方式:尾静脉注射
病毒:AAV9-NPHS1-eGFP(White) ; AAV9-CMV-eGFP(Black)
注射量:1×1012 vg/mouse
小结: AAV转导肾基因的效率应结合注射方式、血清型及启动子等多方面综合考虑,建议在进行实验前查阅相关文献并进行预实验测定。
[1]. van der Wouden, E.A., et al., Approaches and methods in gene therapy for kidney disease. J Pharmacol Toxicol Methods, 2004. 50(1): p. 13-24.
[2]. Rubin, J.D. and M.A. Barry, Improving Molecular Therapy in the Kidney. Mol Diagn Ther, 2020. 24(4): p. 375-396.
[3]. Shen X, Xu Y, Bai Z, Ma D, Niu Q, Meng J, et al. Transparenchymal Renal Pelvis Injection of Recombinant Adeno-Associated Virus Serotype 9 Vectors Is a Practical Approach for Gene Delivery in the Kidney. Hum Gene Ther Methods. 2018 12;29(6):251–8.
[4]. Schievenbusch, S., et al., Combined paracrine and endocrine AAV9 mediated expression of hepatocyte growth factor for the treatment of renal fibrosis. Mol Ther, 2010. 18(7): p. 1302-9.
[5]. Rocca, C.J., et al., rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther, 2014. 21(6): p. 618-28.
[6]. Saito, S., et al., rAAV6-mediated miR-29b delivery suppresses renal fibrosis. Clin Exp Nephrol, 2019. 23(12): p. 1345-1356.
[7]. Jing, X., et al., Gene deficiency or pharmacological inhibition of PDCD4-mediated FGR signaling protects against acute kidney injury. Acta Pharm Sin B, 2021. 11(2): p. 394-405.
[8]. Jason L Picconi et al. Kidney-specific expression of GFP by in-utero delivery of pseudotyped adeno-associated virus 9 Mol Ther Methods Clin Dev. 2014; 1: 14014.
AAV在肾脏研究中的案例分享『应用篇』 (可点击查看)