当前位置:首页 > 研究领域 > 消化系统
当前位置:首页 > 研究领域 > 消化系统
肝脏作为较早被用于基因治疗的器官,多年来研究热度有增无减,前期小V已经与大家共同学习了在肝脏应用中关于AAV的选择策略,今天小V将分享几个利用维真生物AAV进行肝脏研究的文献案例:
非酒精性脂肪性肝炎(NASH)相关的肝细胞癌和肝病已成为发达国家需要肝移植的主要原因。脂质过度积累导致的脂毒性能够引起内质网应激和破坏蛋白质稳态,在NASH中发挥核心作用。目前还没有批准任何药物疗法用于治疗NASH,因此探究NASH的发展机制,寻找潜在的治疗靶点至关重要。
在本研究中,为了确定减轻脂毒性有害后果的关键分子,作者进行了综合多组学分析,确定了E3连接酶TRIM16为候选分子,进一步分析发现TRIM16在脂毒性反应中显著上调,并且过表达TRIM16(AAV8腹腔注射)减轻了NASH小鼠模型的脂质积累和肝损伤。同时,作者还阐明了TRIM16调控NASH的机制,即TRIM16通过优先与磷酸化的TGF-β活化激酶 1 (TAK1) 相互作用并通过催化K48连接的泛素化促进其降解,来减弱丝裂原活化蛋白激酶 (MAPK)信号通路的激活,进而抑制NASH的发展。总的来说,该研究表明TRIM16是一种特定的TAK1调节器,可以在NASH中作为潜在的治疗靶标。

| 病毒产品 | AAV8-CMV-TRIM16&AAV8-CMV-GFP |
| 实验动物 | 8周龄HFHC喂养C57BL/6J 小鼠(NASH小鼠模型) |
| 注射方式 | 腹腔注射 |
| 病毒滴度 | 1x10E13vg/ml |
| 检测时间 | 8周后 |
如图2所示,AAV8-TRIM16注射后,Western blot和qPCR分析均表明TRIM16在小鼠肝脏中过表达成功。与对照组(AAV-GFP)相比,注射AAV8-TRIM16的小鼠在经HFHC喂养16周后,肝脏重量和肝体重比明显降低,此外,TRIM16过表达显著减缓了HFHC喂养小鼠肝脏中的脂质积聚、炎症、纤维化和肝损伤。

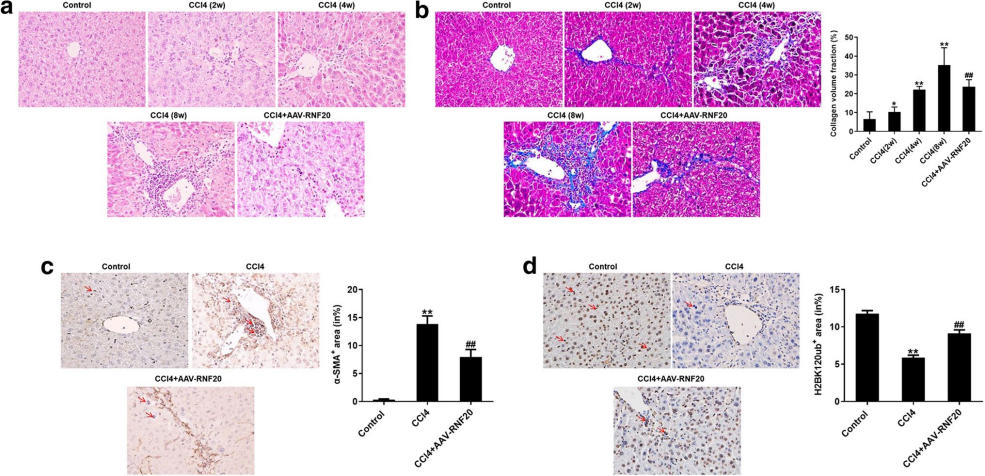
肝纤维化是一种慢性肝损伤,可导致肝硬化和肝癌。RNF20(环指蛋白20)又称E3泛素蛋白连接酶BRE1A,已被报道参与慢性肝病,然而,RNF20在肝纤维化中的作用尚不清楚。研究人员先后通过肝纤维化模型的体内外研究证实,RNF20过表达可显著抑制体内外肝纤维化的进展,表明RNF20有望成为治疗肝纤维化的新靶点。
| 病毒产品 | AAV8-TBG-RNF20 |
| 实验动物 | C57BL/6J小鼠 |
| 注射方式 | 尾静脉注射 |
| 病毒滴度 | 7.94×10E13 vg/ml |
| 注射量 | 1×10E9pfu/mouse |
| 检测时间 | 8周后 |
为探究RNF20在肝纤维化中的作用,研究人员建立了活体肝纤维化模型,如图3所示,使用AAV8过表达RNF20显著逆转了小鼠肝组织中由CCl4引起的炎性浸润和胶原体积,同时逆转CCl4导致的α-SMA的表达增加和H2BK120ub蛋白水平的降低,这些结果表明,RNF20过表达可明显减轻体内肝纤维化症状。
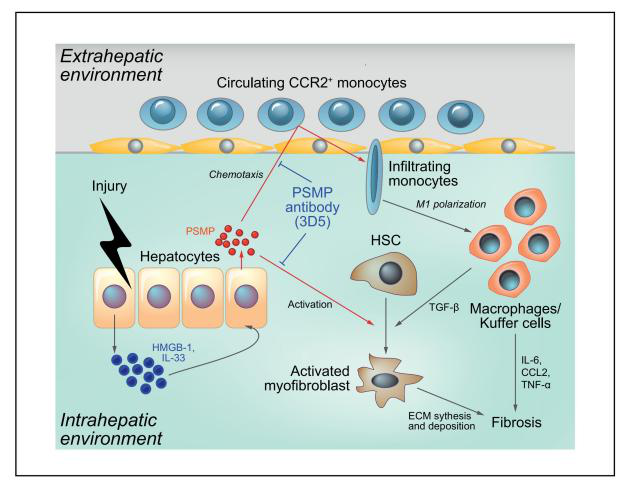
肝纤维化是一种慢性肝损伤的伤口愈合反应,其特征是细胞外基质(ECM)在肝脏过度沉积,最终导致肝功能丧失和肝脏结构破坏。研究表明,趋化因子受体系统在肝脏疾病的发病机制中起着关键作用,C-C基序趋化因子受体2(CCR2)被认为是治疗肝纤维化很有前景的一个靶点。PC3分泌微蛋白(PSMP)/微精原蛋白(MSMP)是一种新型的趋化细胞因子,作为CCR2配体可以募集外周血单核细胞和淋巴细胞,可能影响炎症和癌症的发展。
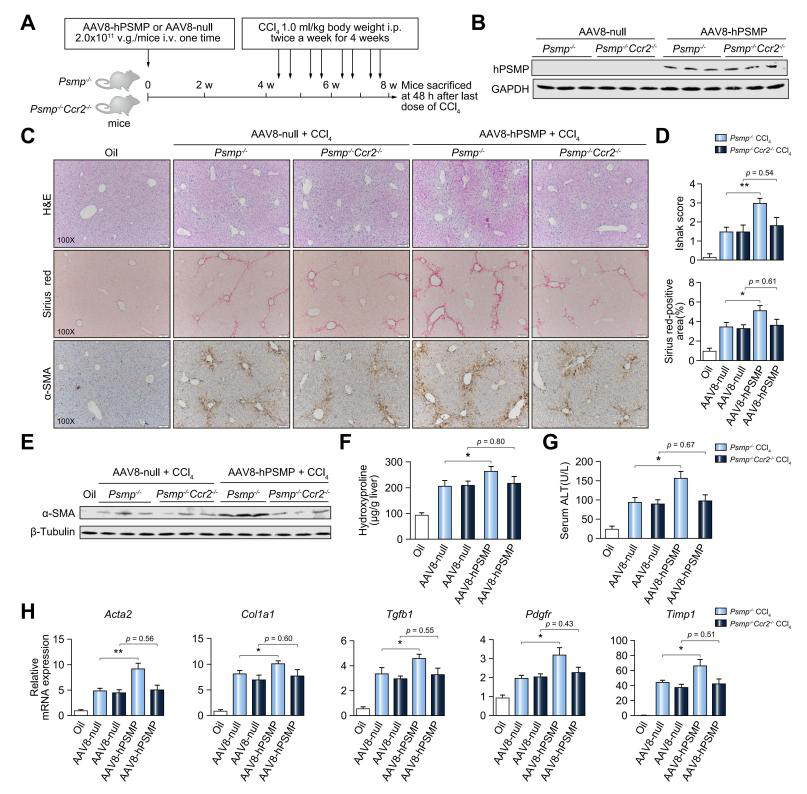
首先,研究者通过免疫组织化学检测了不同肝脏疾病组织中的PSMP水平,发现PSMP在肝纤维化患者肝组织中表达较高。接着,构建了PSMP敲除小鼠(PSMP-/-小鼠),发现PSMP-/-小鼠血清丙氨酸转氨酶(ALT)水平明显降低,肝损伤得到改善。利用AAV8载体在PSMP-/-小鼠过表达hPSMP,发现肝损伤和纤维化显著加重;并通过构建PSMP和CCR2双敲除小鼠模型发现PSMP过表达以CCR2依赖的方式促进肝纤维化的发展。作者揭示了PSMP通过促进炎症巨噬细胞浸润、M1极化、促炎细胞因子产生以及通过CCR2直接激活肝星状细胞进而加速肝纤维化,提出PSMP可能是一个潜在的肝纤维化治疗靶点,其抗体可能是治疗肝纤维化的潜在药物。
| 基因信息 | hPSMP(人类PC3分泌型微蛋白,一种新型的趋化细胞因子,受体为CCR2) |
| 病毒产品 | AAV8-hPSMP&AAV8-null |
| 实验动物 | 6-8周龄C57BL/6J雄性小鼠 |
| 注射方式 | 尾静脉注射 |
| 注射剂量 | 100μL,2×10E11vg |
| 检测时间 | 8周后 |
通过尾静脉注射AAV8-hPSMP后,PSMP-/-小鼠肝脏PSMP表达量显著升高,注射4周后PSMP依旧有较高的表达。接着再用CCl4处理以诱导肝纤维化,发现PSMP过表达引起的肝损伤和纤维化显著加重,并通过构建PSMP和CCR2双敲除小鼠模型发现PSMP过表达以CCR2依赖的方式促进肝纤维化的发展。
类泛素化修饰(Neddylation)是一种通过将NEDD8与特定底物蛋白中的赖氨酸共价结合,控制细胞的生存和增殖的泛素化样途径。但是,类泛素化在哺乳动物代谢中的生理作用尚不明确,也没有明确的线粒体靶点。肝脏特异性UBA3缺乏会导致类似戊二酸尿症II型(GA-II)的系统性异常,GA-II是一种罕见的常染色体隐性遗传性脂肪酸氧化障碍疾病,由线粒体电子转移黄素蛋白(ETF:ETFA和ETFB)或相应的泛醌氧化还原酶缺陷引起。然而ETFA和ETFB蛋白水平在转录后水平调控的机制尚不清楚。
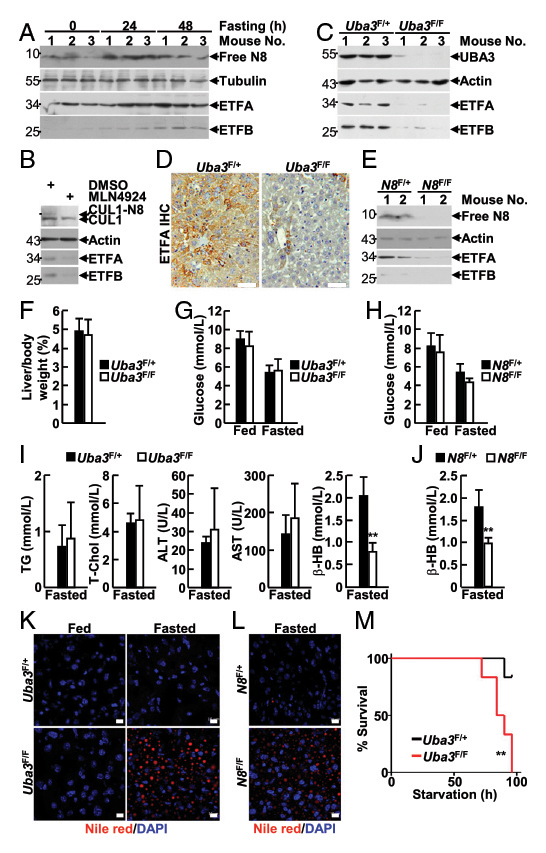
在本研究中,作者构建的肝脏特异性UBA3和NEDD8缺失的小鼠模型,表现出自发性脂肪肝和肝细胞衰老的新生儿死亡,并伴有肝脏脂肪酸-β氧化缺陷;成年小鼠中UBA3的特异性缺失(通过AAV-DJ进行尾静脉注射)导致ETF蛋白的减少,并增加禁食诱导的脂肪变性和死亡率。IB和IF分析发现新生小鼠线粒体蛋白也发生类泛素化,免疫共沉淀分析发现ETF蛋白为类泛素化的底物。此外,ETF基因突变导致类泛素化修饰缺陷,促进了GA-II的发病。本研究表明类泛素化修饰是一种可以通过阻断肝细胞内ETFs的泛素化和降解来靶向并稳定ETFs的泛素化样修饰途径,肝类泛素化可防止新生小鼠出现GA-II类异常,降低成年小鼠因禁食引起的死亡率。
| 病毒产品 | AAV-DJ-CAG-Cre |
| 实验动物 | 8周龄C57BL/6J雄性小鼠 |
| 注射方式 | 尾静脉注射 |
| 注射量 | 20 μL |
| 病毒滴度 | 3.0×10E13vg/ml |
| 检测时间 | 6周后 |
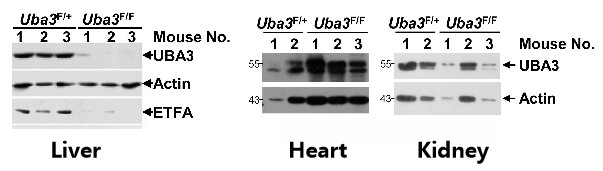
如图6A所示,研究人员将AAV-DJ-CAG-Cre通过尾静脉注射至8周龄雄性Uba3F/F和同窝Uba3F/+ 小鼠体内,IB分析证实Uba3F/F小鼠肝脏中UBA3缺失,但心脏和肾脏中没有,证明肝脏特异性UBA3缺失小鼠模型构建成功。经AAV-DJ-Cre转导后,Uba3F/F小鼠和Nedd8F/F小鼠肝脏中UBA3、Nedd8的缺失导致ETFs蛋白表达水平的显著下降;对小鼠进行禁食处理,研究者发现UBA3、Nedd8的缺失导致小鼠肝脏脂质储存和死亡率增加,表明成年小鼠肝脏中的类泛素化/ETF轴可以预防禁食诱导的脂肪变性和死亡率。
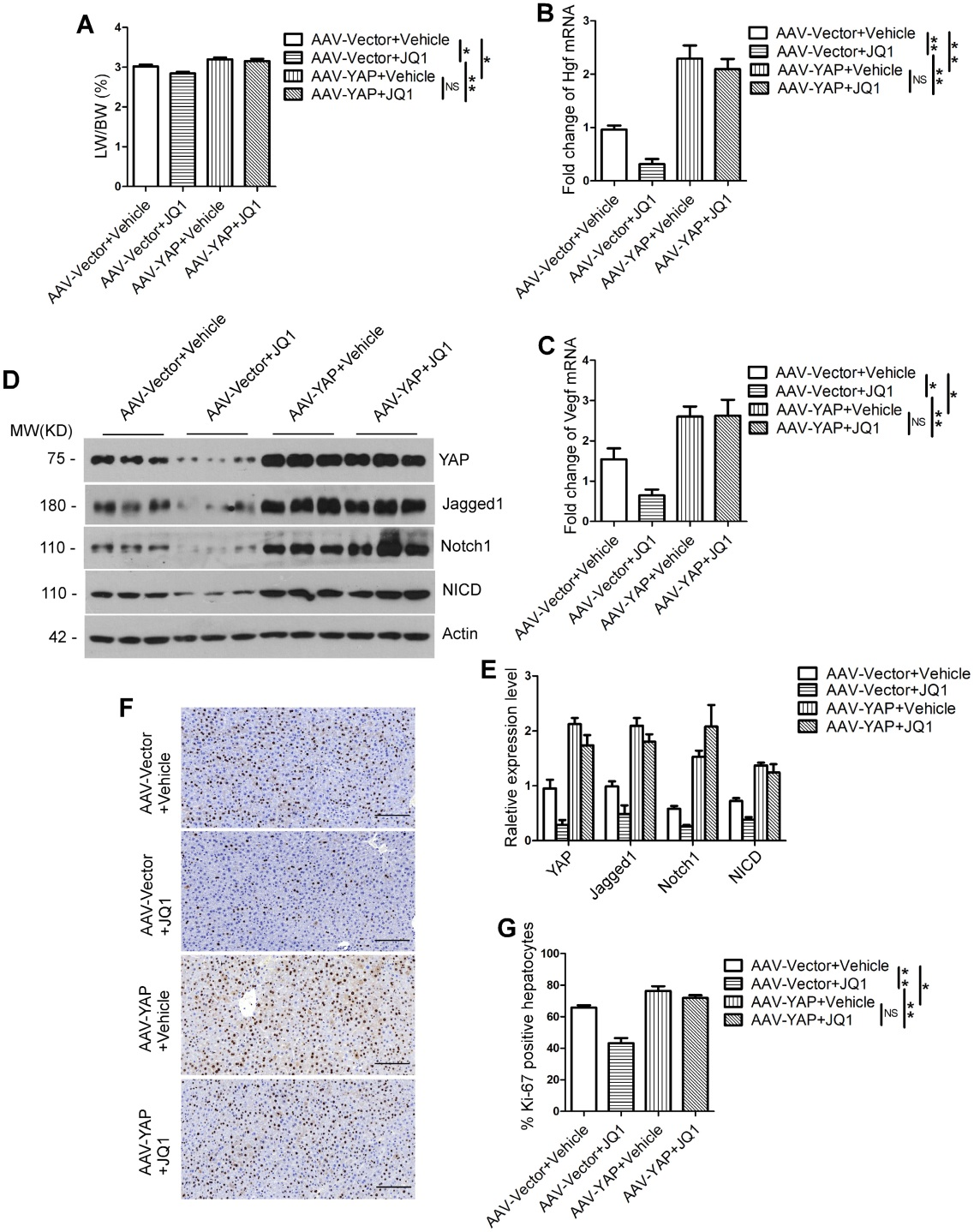
肝脏有很强的再生能力,许多肝脏疾病的治疗都是通过有效的肝再生来调节的。但是,调控肝再生的生物学机制仍不清楚。研究表明,溴域和末端外结构域(BET)蛋白及其抑制剂与肝癌密切相关,此外BET蛋白在斑马鱼的肝再生过程中至关重要,但具体的机制仍需进一步探究。Hippo-YAP/TAZ通路已被证实是调节细胞增殖和器官大小的关键因子,在多种肝疾病中处于激活状态,但其是否参与肝再生过程也尚不明确。
在本研究中,作者发现BET蛋白抑制剂JQ1显著抑制70%肝脏切除术(PH)后的肝再生,并且JQ1可以抑制肝脏细胞的增殖。进一步检测发现JQ1在mRNA和蛋白水平抑制体内肝再生过程YAP/YAZ和Notch信号通路的表达,而YAP/TAZ抑制剂显著下调了YAP、TAZ和Notch信号通路相关基因的表达,并抑制70%PH后肝再生。接着利用AML12-Yap-shRNA细胞系证明了JQ1可以通过抑制AML12细胞YAP的表达,间接下调Notch信号通路的活性,下游分子Notch1被证明是YAP/TAZ的功能靶标。最后发现通过过表达YAP可以补救BET蛋白抑制剂引起的肝再生损伤,揭示了YAP/TAZ–Notch1–NICD在肝再生中的功能以及BET蛋白抑制剂(如JQ1)在肝脏疾病治疗中的风险。
| 基因信息 | YAP(Hippo/Yes-associated protein,Hippo/Yes相关蛋白,被认为是调控肝脏大小的重要因子) |
| 病毒产品 | AAV9-CMV-YAP |
| 实验动物 | 6周龄C57BL/6J雄性小鼠 |
| 注射方式 | 腹腔注射 |
| 注射剂量 | 1×10E11 vg/mice |
| 检测时间 | 4周后 |
腹腔注射表达YAP的AAV9过表达载体,发现YAP显著高表达。与YAP非过表达组相比,YAP过表达后小鼠LW/BW比、肝再生的两个关键调节因子Hgf和Vegf表达水平及Notch信号通路相关蛋白(Jagged1, Notch1和NICD)表达水平均明显升高。不仅如此,Ki-67(细胞增殖指数)阳性肝细胞数量也远远高于YAP非过表达组。这些数据说明,小鼠肝脏中YAP的过表达可以挽救BET蛋白抑制剂对肝再生的损伤。