 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
缝隙连接(Gap junctions)又称间隙连接,是一种重要的跨细胞通道,可以介导分子量小于约1 kD的小分子(如cAMP,IP3,Glucose等第二信使)或离子(氢离子、钙离子、钾离子等)在细胞间的扩散。这种通道广泛地存在于包括脊椎动物和无脊椎动物的各类组织和器官中,介导细胞间的化学和电学信号传递,从而调控发育、维持稳态,保证生物体各个系统的正常工作。缝隙连接功能的缺陷与许多疾病有关,包括心肌梗死、听力丧失和低髓鞘性疾病等。
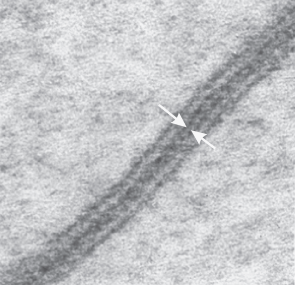
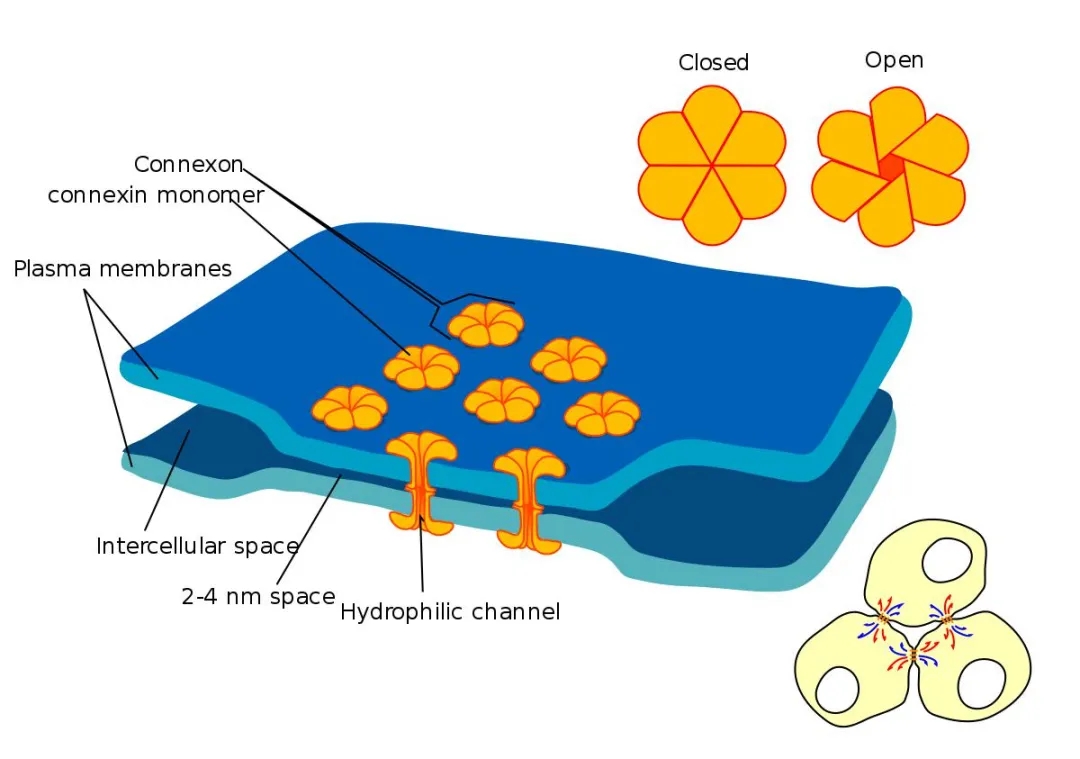
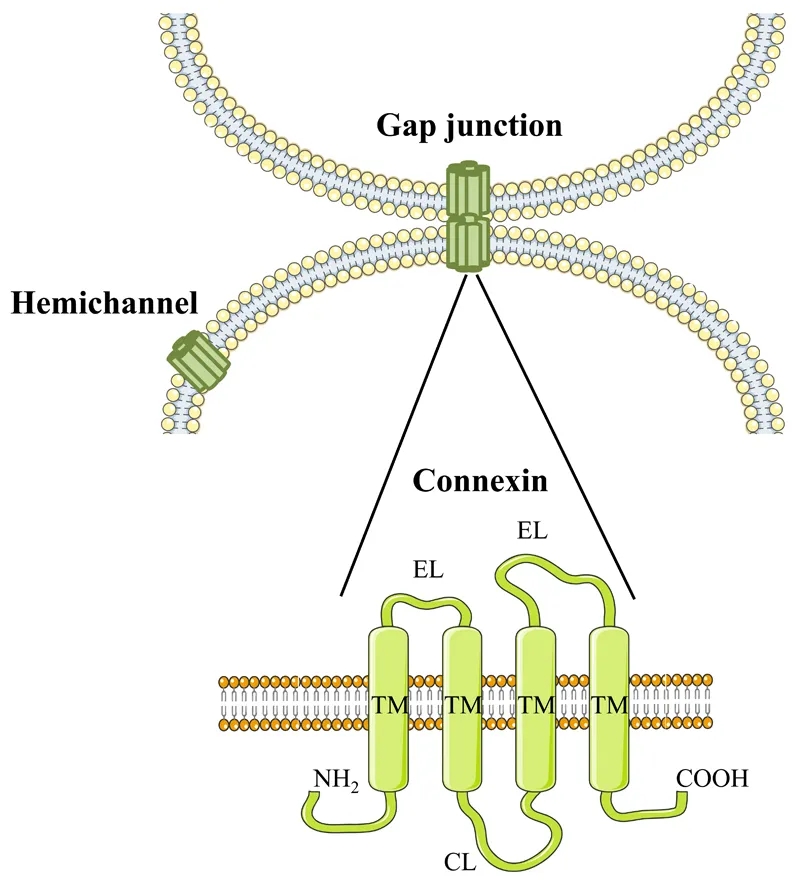
图3. 缝隙连接与单体结构模型
(Joost Willebrords, et al. Cell Commun Adhes, 2016)
连接蛋白存在于兴奋和非兴奋的组织中,除了分化的骨骼肌、红细胞和成熟精子细胞之外的所有组织中都有表达。连接蛋白编码基因的突变与多种遗传疾病(包括耳聋、神经病、白内障、骨骼异常和皮肤病)的发生相关,它们调节免疫反应、细胞增殖、迁移、凋亡和癌变的能力使之成为多种疾病的治疗靶点。
已有研究证明连接蛋白在内质网中合成,在高尔基体中加工形成半通道。新合成的连接蛋白组装成连接子,随后被运输并插入到质膜中。在细胞接触过程中,连接子与对应细胞的连接子正面对接并聚集形成缝隙连接斑块。一旦细胞间通讯不再需要缝隙连接斑块,或细胞迁移,缝隙连接斑块的一部分(通常是中心部分)或整个斑块内化,形成环状缝隙连接。环状缝隙连接可以通过一系列过程降解,包括溶酶体、自噬体等过程。环状缝隙连接囊泡或在环状缝隙连接囊泡降解过程中释放的连接蛋白可能会回到细胞表面循环利用,参与新的或现有缝隙连接斑块的形成(图4)。
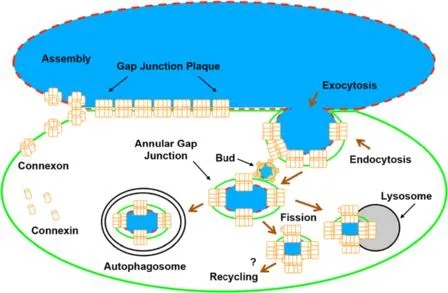
图4. 缝隙连接斑块的形成及降解示意图
(Falk, M.M., et al. BMC Cell Biol, 2016. )
缝隙连接在各种生理过程中发挥重要作用,而在复杂系统(神经系统)的生理或疾病条件下研究缝隙连接耦合需要一种既具有细胞特异性又具有高时空分辨率的非侵入性方法,然而以往用于监测缝隙连接的方法包括电生理记录、染料微注射、荧光漂白恢复(FRAP)和分子荧光探针的局部激活(LAMP),均缺乏细胞特异性及高时空分辨率,并且具有侵入性,因此限制了它们的应用。
为了更好地研究缝隙连接在复杂系统中的分布及生理和病理条件下的功能,2019年,北京大学李毓龙课题组开发了一种新型的、可基因编码的光遗传学缝隙连接检测探针——PARIS(pairing actuators and receivers to optically isolate gap junctions),并将其应用在细胞系、心肌细胞和转基因果蝇的神经系统中重复地检测特定细胞间的缝隙连接通讯。该方法首次实现了运用完全遗传编码的方法在特异的细胞类型中非侵入地对缝隙连接通讯进行成像,它结合了光学的高度时空操纵性和遗传学的特异性,为研究缝隙连接通讯的在体分布、不同生理活动下的功能及调节提供了更多的可能性。
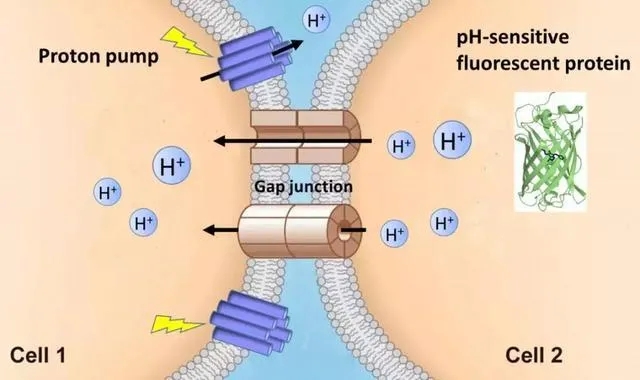
图5. PARIS的作用原理示意图
PARIS包含两部分:第一部分是一个光控质子“泵”(ArchT),它将氢离子输送出细胞;第二部分是一个荧光传感器(质子敏感型荧光蛋白pHluorin,所用AdV-pHluorinCAAX腺病毒由维真生物提供),存在于接收信号的细胞内,它对流出的氢离子做出反应。将二者分别表达在缝隙连接耦合的细胞中,通过光激活质子泵产生跨细胞的质子梯度,再通过pHluorin的荧光变化检测两个相邻细胞间的缝隙连接通讯(如图5所示)。
原文链接:
https://elifesciences.org/articles/43366
研究思路
部分研究结果
1、PARIS与FRAP(荧光漂白恢复技术)在HEK293T细胞中的功能比较
通过对PARIS与FRAP(基于染料扩散的方法检测缝隙连接介导的光漂白后的荧光恢复)的比较发现,相同时间内PARIS信号比FRAP信号更加稳定,未曾出现衰减,而且PARIS信号的动力学比FRAP快速,对应的t1/2分别约为~21s和~197s(图6)。

图6. PARIS与FRAP在HEK293T细胞中的比较
2、PARIS可检测缝隙连接和由连接蛋白编码基因突变引起的疾病
研究表明,磷酸化通过影响缝隙连接的组装、降解和门控等途径参与其调节。接下来,作者探讨了PARIS是否可以在蛋白磷酸化等调节条件下检测缝隙连接:用cAMP类似物8-Br-cAMP、腺苷酸环化酶激动剂Forskolin及蛋白激酶C(PKC)激动剂TPA处理表达PARIS的HEK293T细胞。与对照组相比,经TPA处理细胞后,PARIS信号受到显著抑制,而8-Br-cAMP和Forskolin的处理对其未造成明显影响,表明PKC的激活会抑制缝隙连接。
已知连接蛋白Cx43编码基因GJA1的突变与许多疾病有关,那么PARIS是否可以用来检测连接蛋白编码基因突变引发的疾病呢?作者在不表达内源性连接蛋白的HeLa细胞中表达了PARIS,光激活“质子泵”细胞时,接收器细胞中未产生PARIS信号;而在表达GJA1的HeLa细胞中,光激活“质子泵”细胞时,相邻接收器细胞中产生了强烈的荧光。由于Cx43编码基因GJA1的突变影响了缝隙连接的形成,从而使PARIS信号显著降低。上述结果表明,PARIS可用于检测缝隙连接蛋白编码基因突变造成的疾病(图7)。
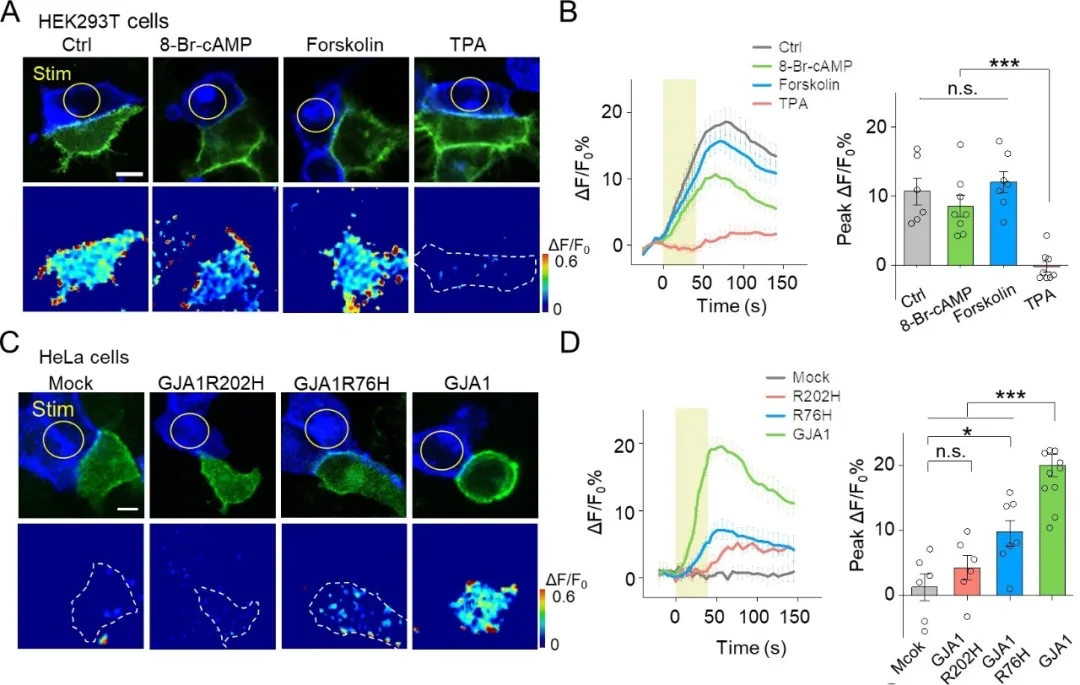
图7. PARIS可检测缝隙连接和由连接蛋白基因突变引起的疾病
3、PARIS可用于报告测心肌细胞间的缝隙连接
由连接蛋白Cx40、Cx43和Cx45形成的缝隙连接在心肌细胞中起着重要作用,它们的的缺陷与心血管疾病有关。作者用培养的新生大鼠心肌细胞,光刺激“质子泵”心肌细胞,在相邻接收器心肌细胞中产生了强烈的荧光,并且这种荧光响应可以被缝隙连接阻滞剂Heptanol可逆阻断。此外,光刺激“质子泵”心肌细胞不影响细胞中自发的钙离子瞬变速率以及细胞搏动的速率,说明PARIS的表达和激活不影响细胞的功能(图8)。
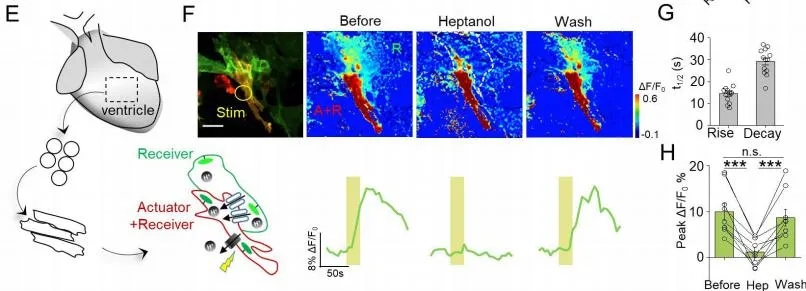
图8. PARIS可监测心肌细胞间的缝隙连接
4、PARIS可监测转基因果蝇特定神经元间的缝隙连接
接着,作者检测了PARIS是否可以用来测量脑细胞间的缝隙连接活动(电突触)。首先,作者在果蝇嗅觉通路的兴奋性投射神经元(ePNs)中表达了PARIS系统,并测量了PARIS信号,结果显示ePNs中的自主PARIS信号可被重复诱导长达2小时,并且信号强度无明显减弱,表明PARIS在完整的活体组织中是稳定的。
随后,作者利用PARIS测量了转基因果蝇兴奋性投射神经元(ePNs)和兴奋性局部神经元(eLNs)间的电突触——两者在触角叶(AL)中都有树突状分支:在ePNs中选择性地表达光控质子“泵”(GH146-QF > QUAS ArchT),在eLNs中选择性地表达荧光传感器(Kras-Gal4 >UAS pHluorinCAAX)。在AL中直径为20 um的区域施加光刺激,引起了pHluorinCAAX荧光的快速增加,半上升和半衰减时间分别约为12 s和29 s,这与先前报道的电生理数据一致,表明ePNS和eLNS是电耦合的。用CBX处理转基因苍蝇或在突变体ShakB2果蝇大脑中(缝隙连接蛋白发生突变)并未出现类似荧光响应,证实了PARIS可用来测量转基因果蝇特定神经元间的缝隙连接。
作者又将AL划分为四个区域,光刺激可以诱导每个区域的荧光增加,表明电耦合在AL中EPNS和ELNS之间是普遍存在的(图9)。
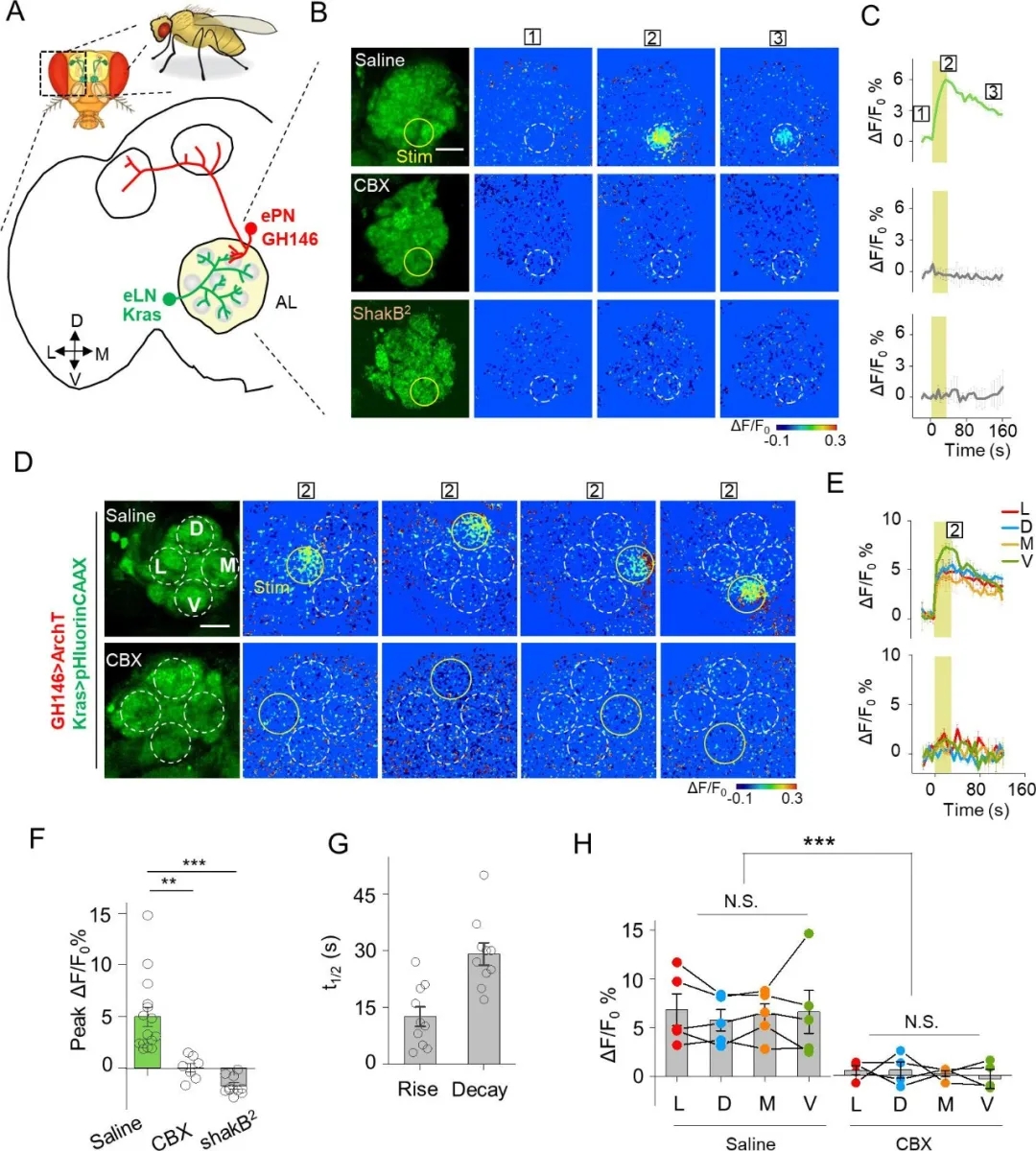
图9. PARIS检测转基因果蝇特定神经元间的缝隙连接
5、PARIS可报告转基因果蝇不同神经元结构中的功能性缝隙连接
在果蝇嗅觉系统中,抑制投射神经元(iPNs)和ePNs形成缝隙连接,参与对气味信息的处理;并且ePNS和iPNS都有投射到AL中的树突以及投射到侧角(LH)的轴突。因此,目前尚不清楚在AL、LH或两者中的iPNS和ePNS之间是否形成缝隙连接。
作者在iPNS中表达了光控质子“泵”(Mz699-Gal4 > UAS ArchT),在ePNS中表达了荧光传感器(GH146-QF > QUAS pHluorinCAAX),然后光刺激AL或LH中ePNS-iPNS重叠的区域,检测是否存在功能性缝隙连接。结果显示,光刺激AL,而不是LH,引起了pHluorinCAAX荧光的显著增加,并且用CBX处理后荧光响应被消除。上述结果表明iPNS和ePNS在AL处通过树突-树突接触形成功能性缝隙连接,而不是在LH中通过轴突-轴突接触。

图10. PARIS监测转基因果蝇不同神经元间的缝隙连接
作者还进一步优化了PARIS系统,通过生物信息学筛选出了比ArchT膜转运性能更优异、光灵敏度更强(约25倍)的新质子泵Lari,扩展了PARIS系统在未来体内应用的前景(图11)。
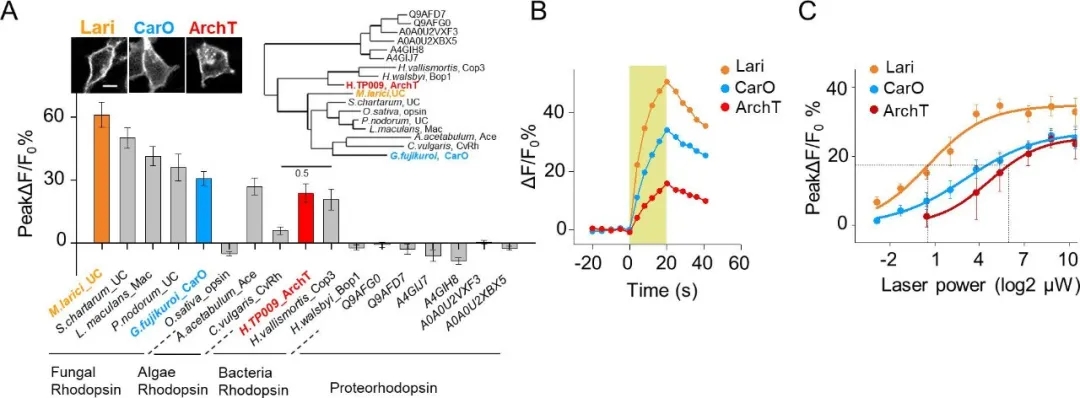
图11. 对PARIS系统的进一步优化
参考文献
[1]. Goodenough, D.A. and D.L. Paul, Gap junctions. Cold Spring Harb Perspect Biol, 2009. 1(1): p. a002576.
[2]. Joost Willebrords, et al. Cell Commun Adhes, 2016. 22(2-6):29-37.
[3]. Beyer, E.C. and V.M. Berthoud, Gap junction gene and protein families: Connexins, innexins, and pannexins. Biochim Biophys Acta Biomembr, 2018. 1860(1): p. 5-8.
[4]. Falk, M.M., et al., Molecular mechanisms regulating formation, trafficking and processing of annular gap junctions. BMC Cell Biol, 2016. 17 Suppl 1: p. 22.