 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
上期我们带大家全面深入地了解了荧光蛋白,本期我们将和大家一起学习荧光蛋白的具体应用。
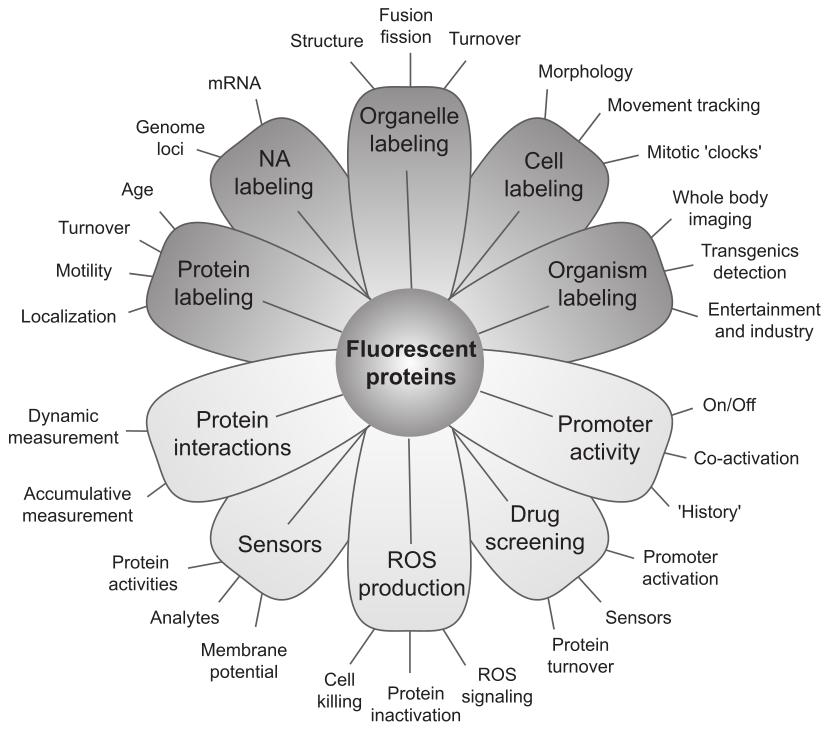
如今,FPs作为标记蛋白和报告蛋白被广泛应用于生命科学研究的诸多领域,以研究生命系统的组织和功能(图1)。
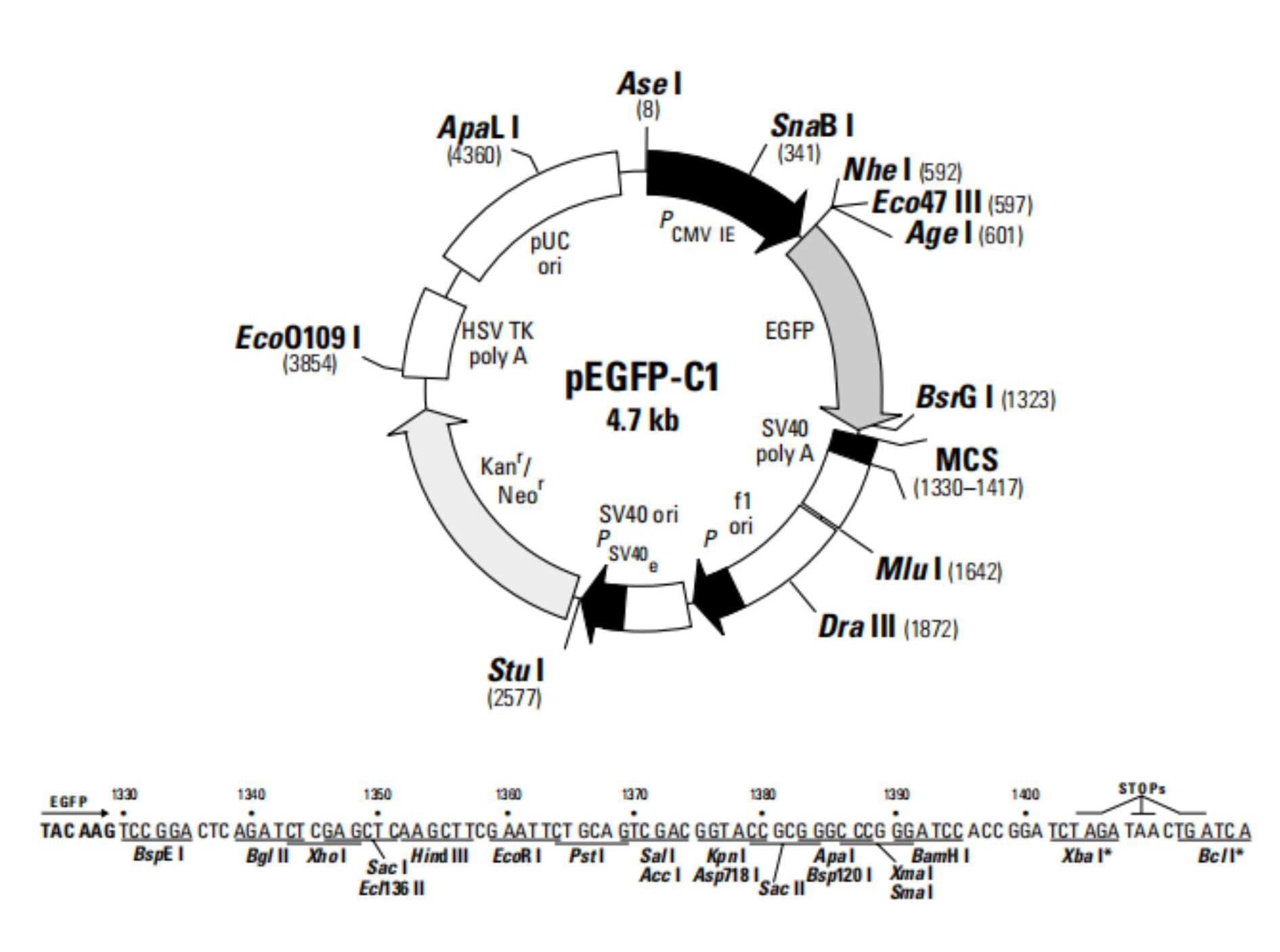
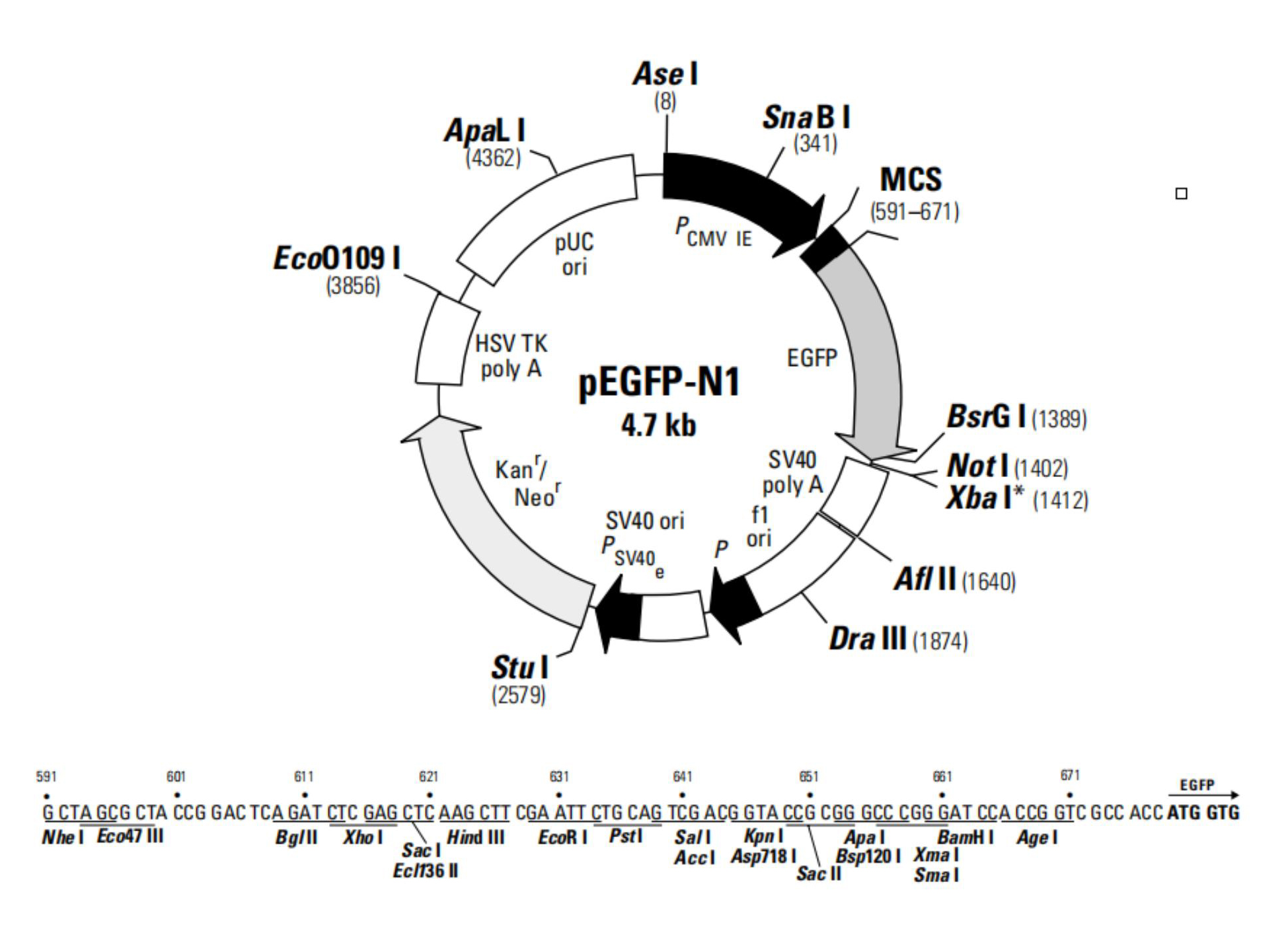
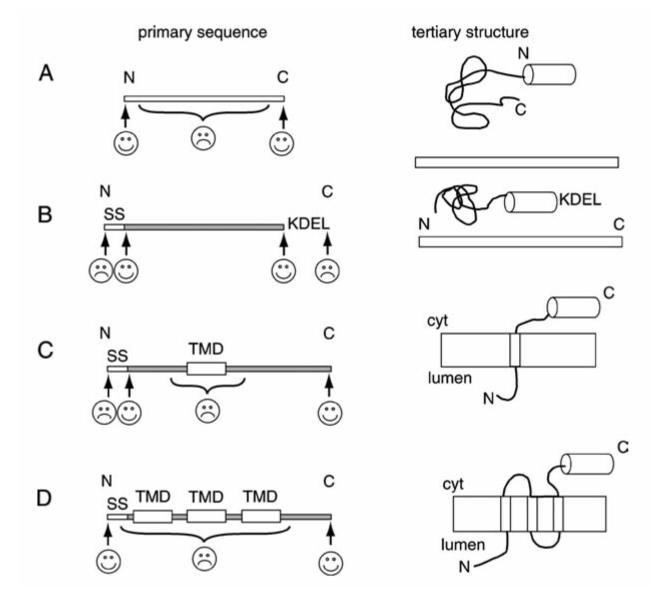
作为标记蛋白,构建荧光融合蛋白(Fluorescent Fusion Protein, FFP)可以用于研究蛋白定位,追踪其动态变化,追溯其历史和研究蛋白之间的相互作用。那么,如何构建FFP呢?在设计FFP时,我们需要考虑多方面的因素,如FFP的预期用途,选择哪种FP,插入位置等等。随着FPs的发现和发展,很多荧光蛋白载体可通过商业化公司获得。纵观这些载体,FP通常位于多克隆位点附近(即目标蛋白的N端或C端,图2)。在根据上述FP选择指南选定载体后,我们仅需通过简单的亚克隆技术将目标蛋白克隆至多克隆位点区即可。当FP位于目标蛋白C端时,为了确保两者的正确折叠和功能,一段由2-10个氨基酸组成的链接序列(GS间隔,linker)往往是有用的。
但是,在许多情况下,我们需要根据目标蛋白的实际情况修饰FFP,如内质网蛋白和膜蛋白:一个典型的内质网蛋白通常含有两段关键序列(信号序列,SS;内质网滞留序列,KDEL),若其功能域靠近C端,FP应置于SS下游2-10个氨基酸处,这样可以提高SS的切割效率,并有利于FFP的内质网易位;若其功能域靠近N端,FP应插入KDEL之前;对于单次跨膜蛋白,FP不能置于跨膜结构域(TMD)内/附近,因为这将破坏结构域并导致膜整合的问题;对于多次跨膜蛋白,除了单次跨膜蛋白的不适位置外,FP也不可置于TMDs之间的环内,因为TMDs之间的精确间距对于其正确折叠非常重要,且这些环通常包含功能域(图3)。另外,还有些目标蛋白在成熟过程中会切掉一段,如自噬标志物LC3。
总之,不管如何构建FFP,我们均需要确保FFP的序列正确,并通过实验确认其是否发光,其定位模式是否与目标蛋白的类似,是否保留有目标蛋白的功能等等。
作为报告蛋白,FPs借助极具市场前景的AAV病毒载体被广泛应用于神经科学研究的各个阶段,包括神经标记,基因操作,生理操纵和生理观察。下面我们仅列举几个例子说明:
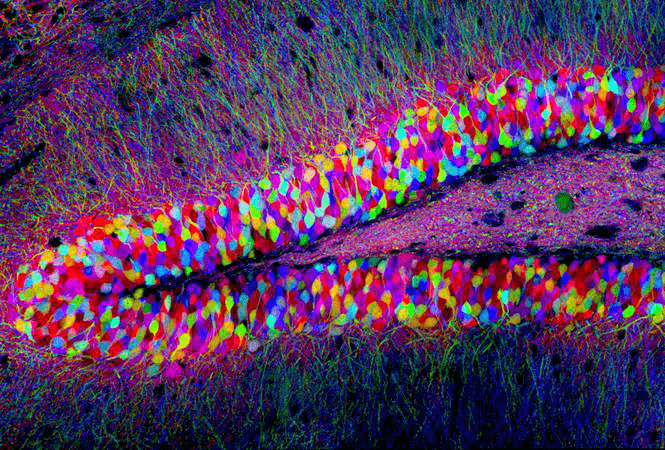
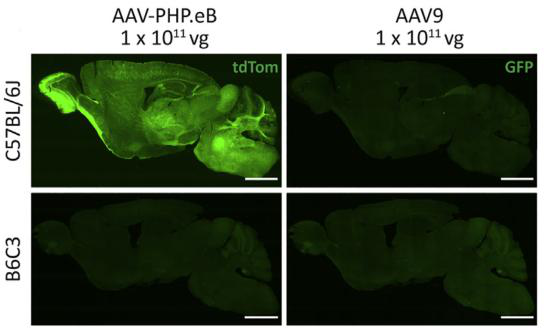
案例1: FPs用于标记全脑和局部脑区的神经细胞(图4)
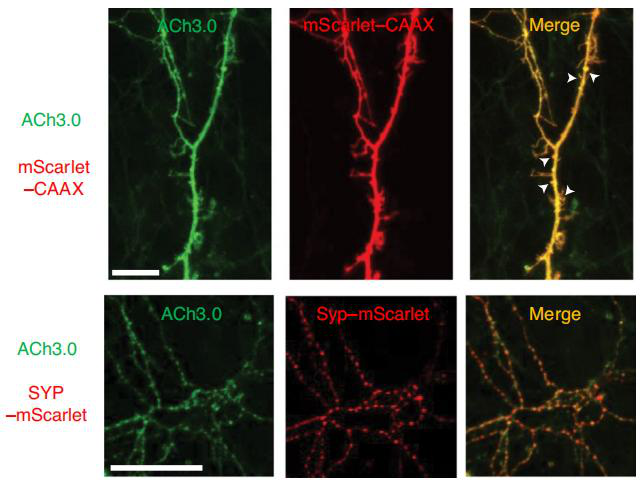
案例2: 添加靶序列和滞留序列的FPs用于标记亚细胞结构和追踪其动态变化(图5)
随着技术的进步,越来越多的FPs被开发并应用。因此,科研人对于FPs可以说是众所周知。尽管目前已有的FPs为科研人的各种成像实验带来了众多选择。但是,随着研究的深入,科研人对于成像实验提出了更高的需求,尤其在神经网络纵横交错的神经系统中体现地淋漓尽致。未来,亮度高、稳定性高的单体FPs将可以进行更密集的成像实验;高效折叠的单体光转换FPs将提高我们光标记融合蛋白的能力,FPs光谱的长波长端将继续拓宽,使科研人能够在深组织和整个动物中进行更灵敏、更高效的成像实验。
1. Chudakov, D. M., et al. (2010). "Fluorescent proteins and their applications in imaging living cells and tissues." Physiol Rev 90(3): 1103-1163.
2. Mathiesen, S. N., et al. (2020). "CNS Transduction Benefits of AAV-PHP.eB over AAV9 Are Dependent on Administration Route and Mouse Strain." Mol Ther Methods Clin Dev 19: 447-458.
3. Jing, M., et al. (2020). "An optimized acetylcholine sensor for monitoring in vivo cholinergic activity." Nat Methods 17(11): 1139-1146.
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









