 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
周围神经损伤是临床常见多发疾病,可由外伤、感染、压迫、缺血、肿瘤和营养代谢障碍等多种原因引起。周围神经损伤后,轴突再生速度减慢,在长期的慢性去神经支配期间,肌肉纤维逐渐萎缩和退化,导致神经肌肉功能不可逆丧失。因此,加快神经轴突的再生速度,缩短神经再支配的时间,可能是改善周围神经损伤后功能恢复和防止实质性肌肉萎缩发生的有效途径。
DNA结合抑制剂2 (Inhibitor of DNA binding 2, Id2)作为碱性螺旋-环-螺旋(bHLH)转录因子的负调控因子,可抑制细胞分化,促进细胞增殖,已有研究表明,Id2能促进中枢神经系统损伤后的轴突再生,然而是否可以促进周围神经损伤后轴突再生和功能恢复,尚不清楚。
新近研究发现,Id2同样可以促进周围神经损伤后轴突再生和损伤神经的功能恢复。过表达Id2(AAV9,立体定位注射脊髓腹角,维真生物提供)促进了坐骨神经损伤后轴突再生以及神经肌肉接头的再神经化,改善了损伤神经的功能。
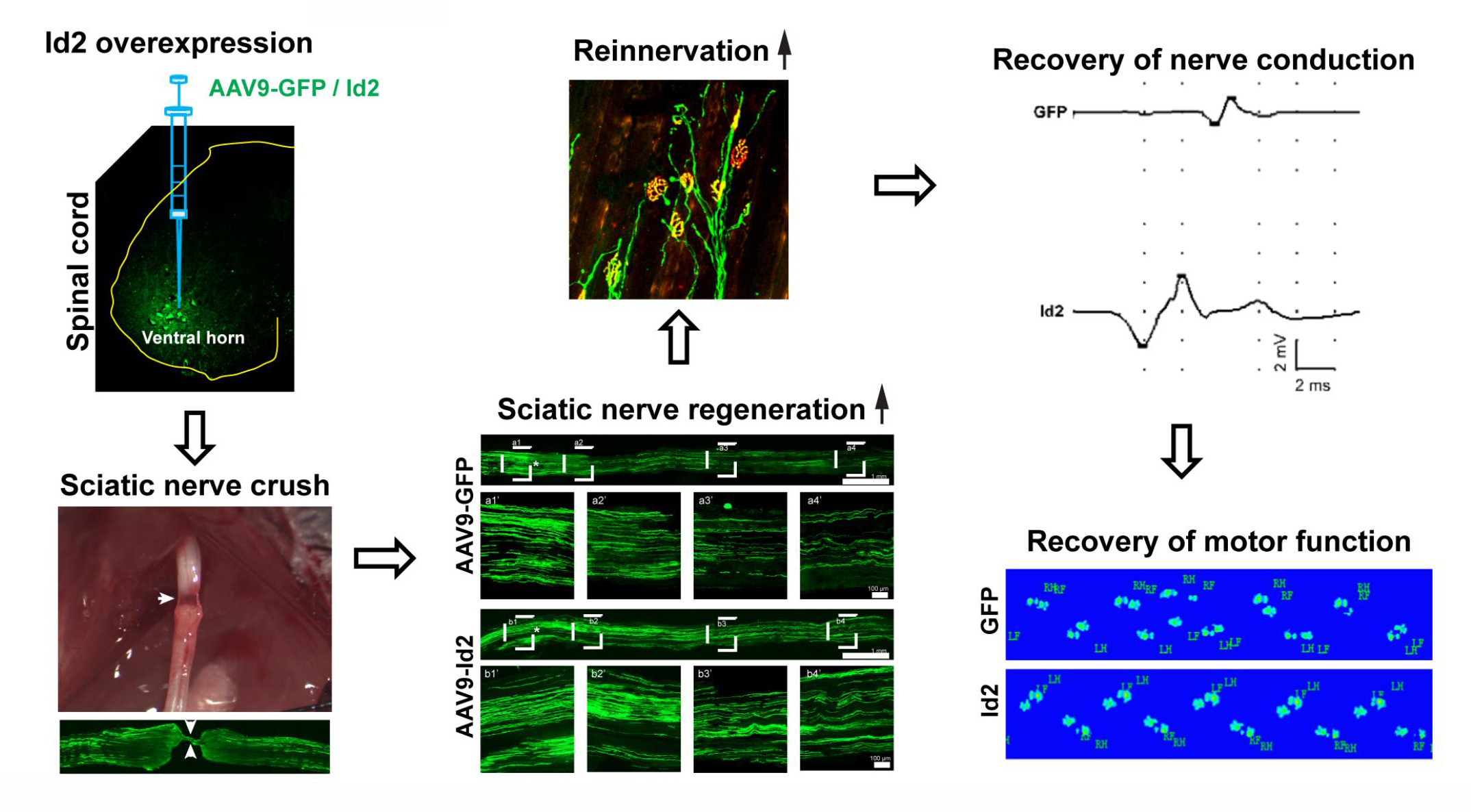
首先,研究者建立了坐骨神经挤压模型。从图2可以看出坐骨神经损伤后GFP+轴突完全损坏,而神经外膜仍保持连续性。通过电生理实验也发现刺激坐骨神经后诱发的复合肌肉动作电位在坐骨神经损伤后1天消失,证实坐骨神经挤压模型构建成功。
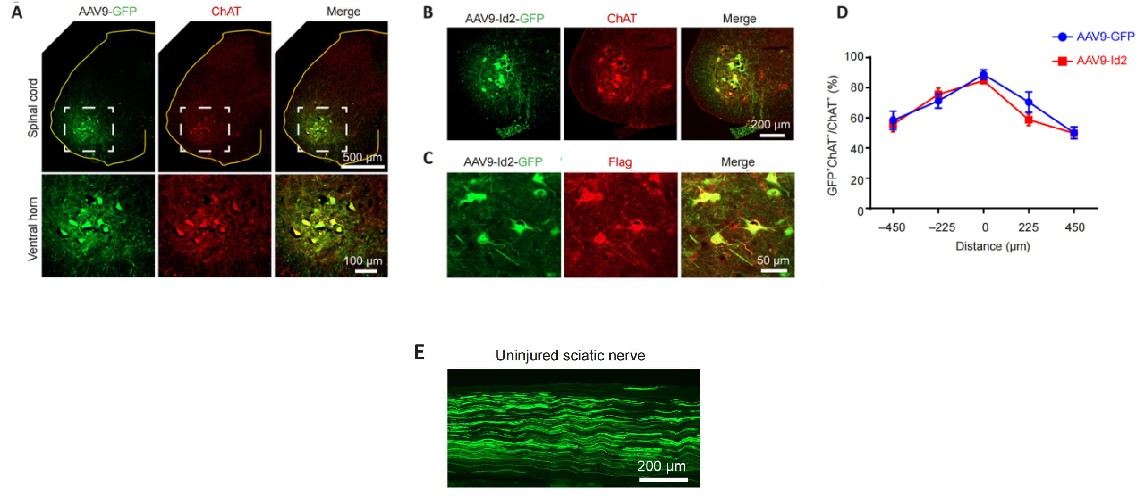
将成年雌性C57BL/6小鼠麻醉后,进行椎板切除术暴露脊髓,将滴度为 6×10E12vg/mL的AAV9-Id2-3×Flag-GFP和AAV9-GFP 分别通过 立体定向注射至脊髓双腹侧角。每只小鼠注射四个部位(左右腹角各两个),每个部位注射0.5 μL的病毒量。
病毒注射2周后,Id2实验组和GFP对照组均可见ChAT+运动神经元与GFP的共标记(图3A ,B)。抗Flag抗体染色实验也证实了Id2-Flag融合蛋白在感染神经元中的成功表达(图3C)。从整体感染效率来看,Id2实验组和GFP对照组相当,注射中心有80%以上的ChAT+运动神经元被成功感染(图3D)。而且,投射到坐骨神经的轴突也被GFP所标记(图3E),可以评估损伤后坐骨神经的再生情况。
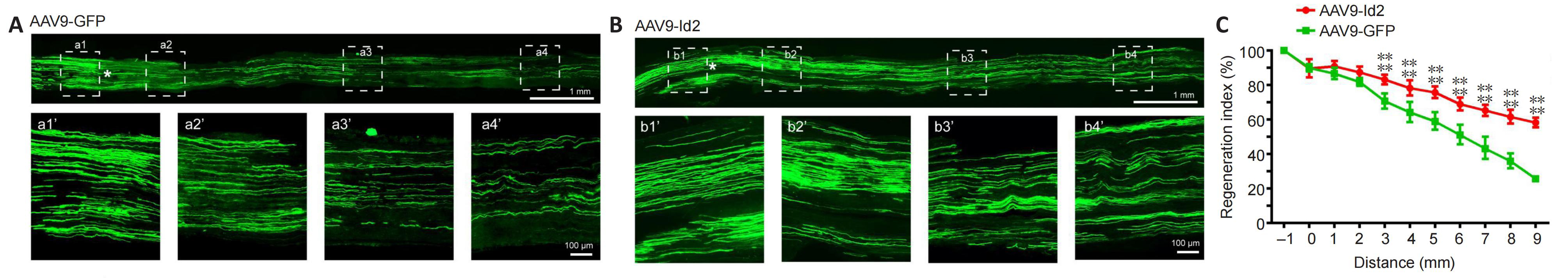
接下来,研究者分别对距离受损部位不同位置处的从腰脊髓运动神经元中投射出的GFP+轴突的数量进行了量化,以此评估坐骨神经损伤后的轴突再生情况。由于周围神经仍具有较强的再生能力,因此可以看到,GFP组和Id2组在坐骨神经损伤后2周均有大量GFP+轴突延伸到损伤部位之外。通过观察,研究者发现两组在1mm和2mm处的GFP+轴轴突数量相当,并无显著差异。然而,在距离受损部位3mm以上的位置处,Id2组GFP+轴轴突数量明显多于GFP组。此外,在距离受损部位超过9mm时,Id2组轴突再生的数量约为60%,而GFP组却不足30%(图4)。腓肠肌受坐骨神经下行的胫神经支配,如图5所示,在坐骨神经受损后两周,GFP组腓肠肌内只可见少量GFP+轴神经纤维,而Id2组GFP+轴神经纤维数量出现明显增加。以上结果说明,Id2能够促进坐骨神经损伤后的轴突再生。
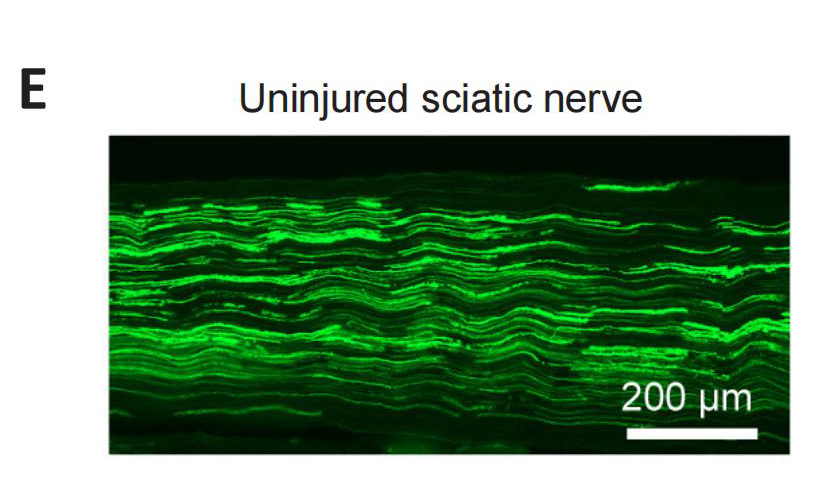
为了进一步研究Id2在神经修复中的促进作用,研究者用α-银环蛇神经毒素标记腓肠肌运动终板检测了神经-肌肉接头(NMJ)处的再神经化。早在坐骨神经受损后2周,在Id2组就观察到腓肠肌内少数终板被GFP+运动轴突末端重新支配,而在对照组中未观察到。坐骨神经受损1个月后,GFP组和Id2组均发生了广泛地神经肌肉再支配。然而,在Id2组中,被GFP+运动轴突重新支配的NMJs的总数明显更多。这表明,Id2促进了坐骨神经损伤后神经-肌肉接头处的再神经化(图6)。
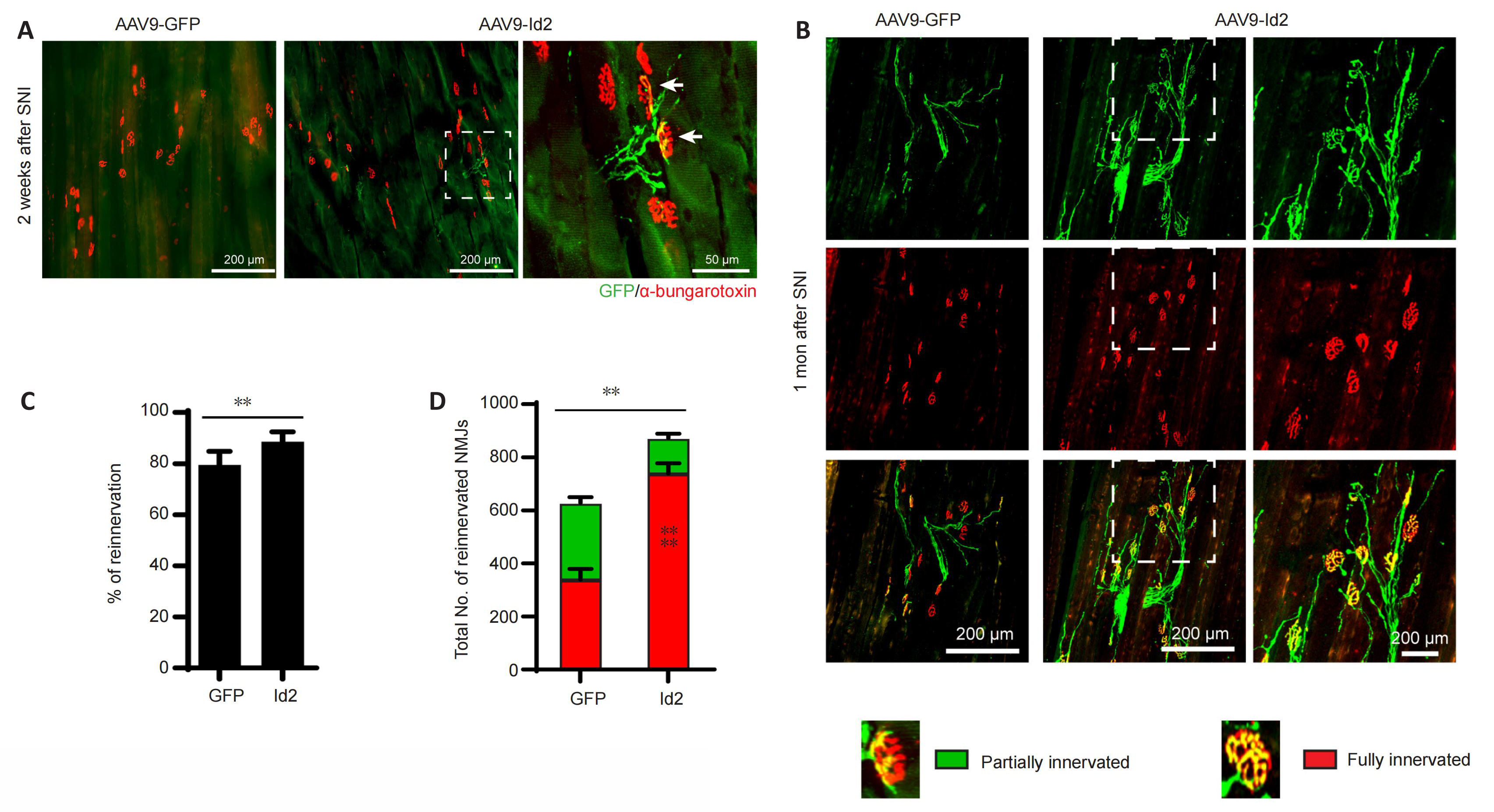
在坐骨神经受损后1个月,研究者对神经传导和运动功能的恢复情况进行了评估。通过记录腓肠肌的复合肌肉动作电位,发现在坐骨神经受损后,复合肌肉动作电位会出现波幅降低,潜伏期延长,与GFP组相比,注射Id2组的复合肌肉动作电位振幅明显升高,潜伏期缩短,这表明Id2的过表达有效恢复了神经肌肉的传导功能(图7)。
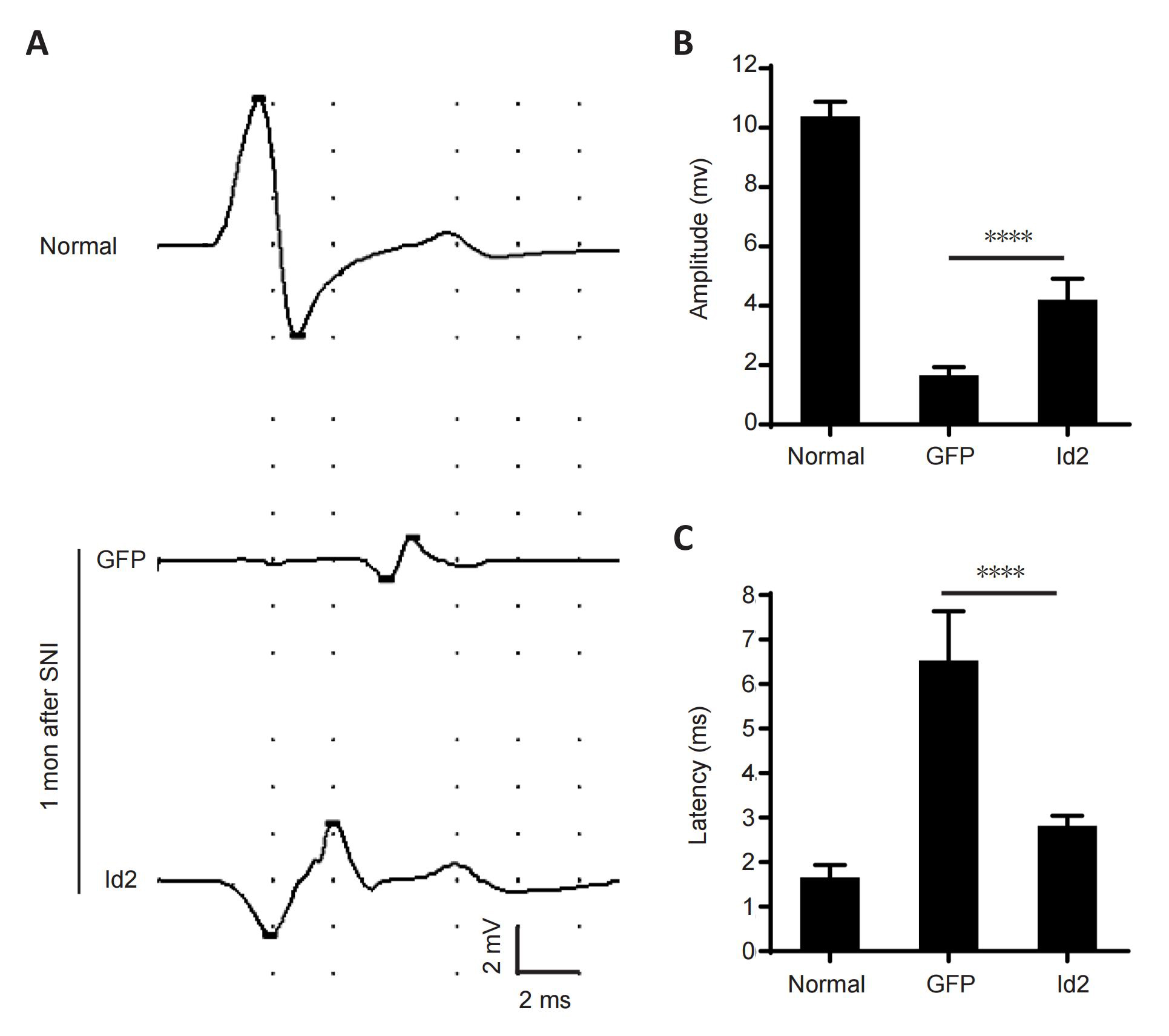
CatWalk步态分析系统是一种评估小鼠坐骨神经损伤后运动损伤和恢复的重要工具,文章最后,研究者利用这一系统在小鼠坐骨神经受损前和损伤后一个月分别进行了测试,发现在坐骨神经损伤后,小鼠的脚印面积和步周长减小,而脚间距离增加。与GFP组相比,Id2过表达的小鼠脚印面积有所增加,脚间距离也恢复至正常水平。以上数据表明,Id2可促进坐骨神经损伤后运动功能的恢复(图8)。
综上所述,Id2可促进小鼠坐骨神经损伤后的轴突再生,神经肌肉再神经化以及坐骨神经功能的恢复,因此提升神经元中Id2的水平可能为修复周围神经损伤提供一个很有前途的策略。
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









