 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
过度的肝脏糖异生和脂肪生成是导致高血糖、高甘油三酯血症、糖尿病和非酒精性脂肪肝(NAFLD)的关键因素,先前的研究深入揭示序列相似家族3成员A(FAM3A)在控制肝脏糖脂代谢、胰岛β细胞功能、脂肪细胞分化等生理病理过程中发挥关键作用。已知线粒体蛋白FAM3A通过刺激ATP释放来激活P2受体途径维持代谢稳态,然而其调节肝细胞ATP释放的机制尚未阐明。
2024年6月27日,北大基础医学院杨吉春教授、北大人民医院迟毓婧副教授及吉林大学第一医院刘兴凯教授团队,在Military Medical Research (IF 16.7)发表“PANX1-mediated ATP release confers FAM3A’s suppression effects on hepatic gluconeogenesis and lipogenesis”。文章揭示了PANX1介导的ATP释放是FAM3A发挥改善肝脏糖脂代谢的关键。


01
研究结果
1、肝脏PANX1在维持糖脂代谢中起着至关重要的作用
RNA测序结合基因表达水平检测发现PANX1在肥胖小鼠肝脏中mRNA水平增加,此外在NAFLD患者和糖尿病小鼠的肝脏中观察到PANX1蛋白水平升高。进行PANX1体外过表达不仅增加了小鼠和人肝细胞胞外的ATP水平,还降低了糖异生和脂质沉积;另一方面,体内PANX1的过表达也显著降低了糖尿病及肥胖小鼠的肝脏糖异生和脂质沉积,敲低PANX1后则得到了与之相反的结果。随后,研究团队构建了PANX1敲除小鼠,与WT小鼠相比,PANX1−/-小鼠的空腹血糖水平显著升高,在ND喂养下表现出糖耐量受损、肝葡萄糖生成增加、胰岛素敏感性降低以及脂质沉积;然而,PANX1的回补改善了上述PANX1−/-小鼠的糖尿病和脂肪肝症状。这些发现揭示了肝脏PANX1在维持葡萄糖和脂质稳态中起着关键作用。
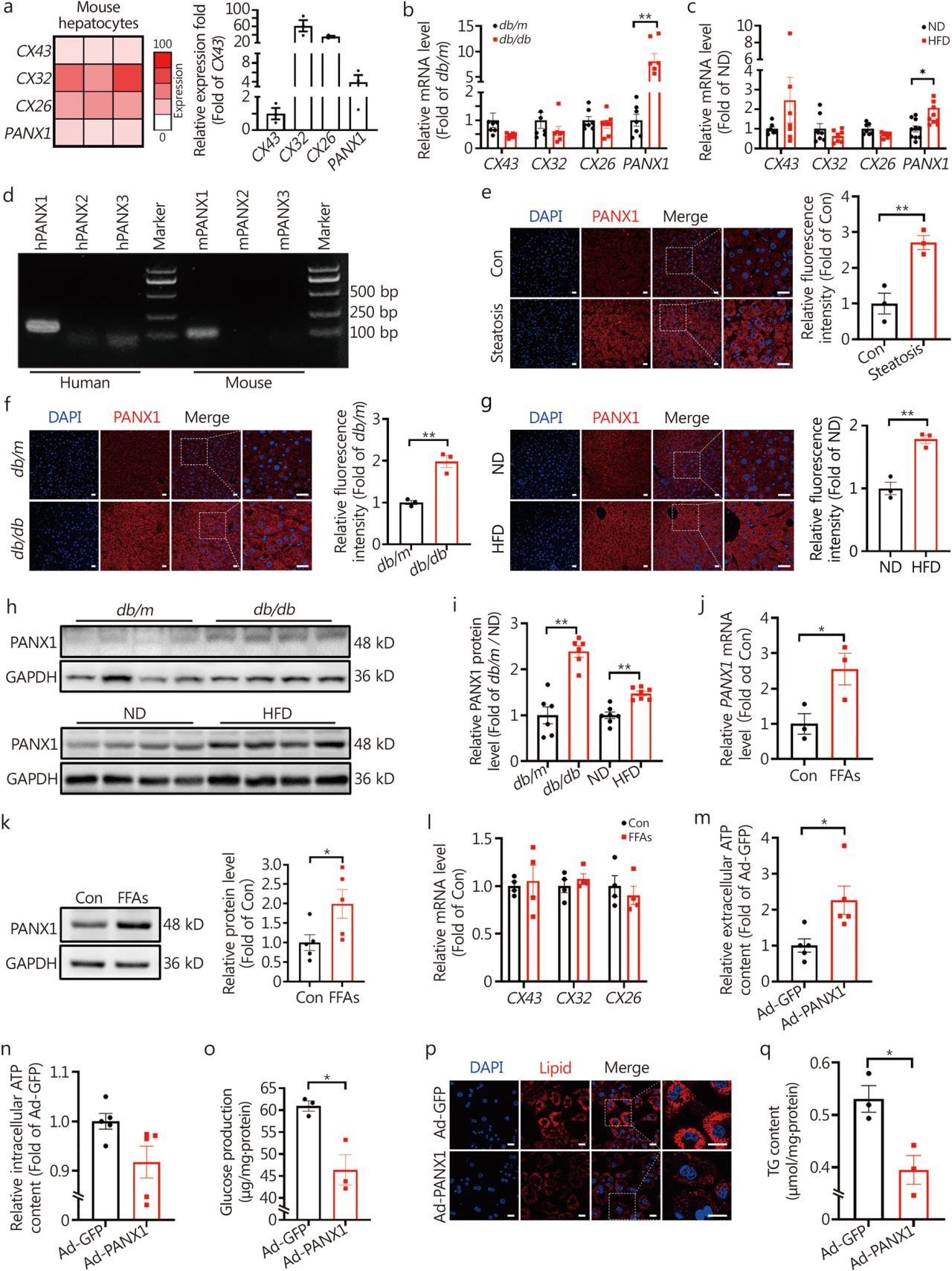
PANX1介导的ATP释放抑制培养肝细胞的葡萄糖生成和脂质沉积
2、PANX1通过抑制JNK-AP1-FAS途径,改善肝脏脂质沉积
接下来,研究团队深入研究了PANX1改善肝脏糖异生和脂质沉积的机制,发现PANX1通过释放ATP和主要激活P2Y受体信号通路来抑制肝糖异生。此外,在PANX1过表达的肝细胞和肝脏中检测到了参与脂质代谢各个方面的关键基因,而FAS是唯一一个在肝细胞和HFD小鼠肝脏中被PANX1持续下调的基因,当PANX1在小鼠肝脏中被敲低或缺失时,FAS蛋白水平增加;PANX1诱导的FAS蛋白水平和脂质沉积的抑制可以通过PBN或P2受体抑制剂suramin给药逆转。以往研究证明释放的ATP作用于P2受体,激活肝细胞中的CaM,而在PANX1过表达后,肝细胞中CaM的蛋白水平升高。进一步的研究证实了CaM和JNK之间存在相互作用,CaM过表达可抑制JNK及转录因子AP1的磷酸化,从而下调脂肪酸合成酶FAS的蛋白水平。
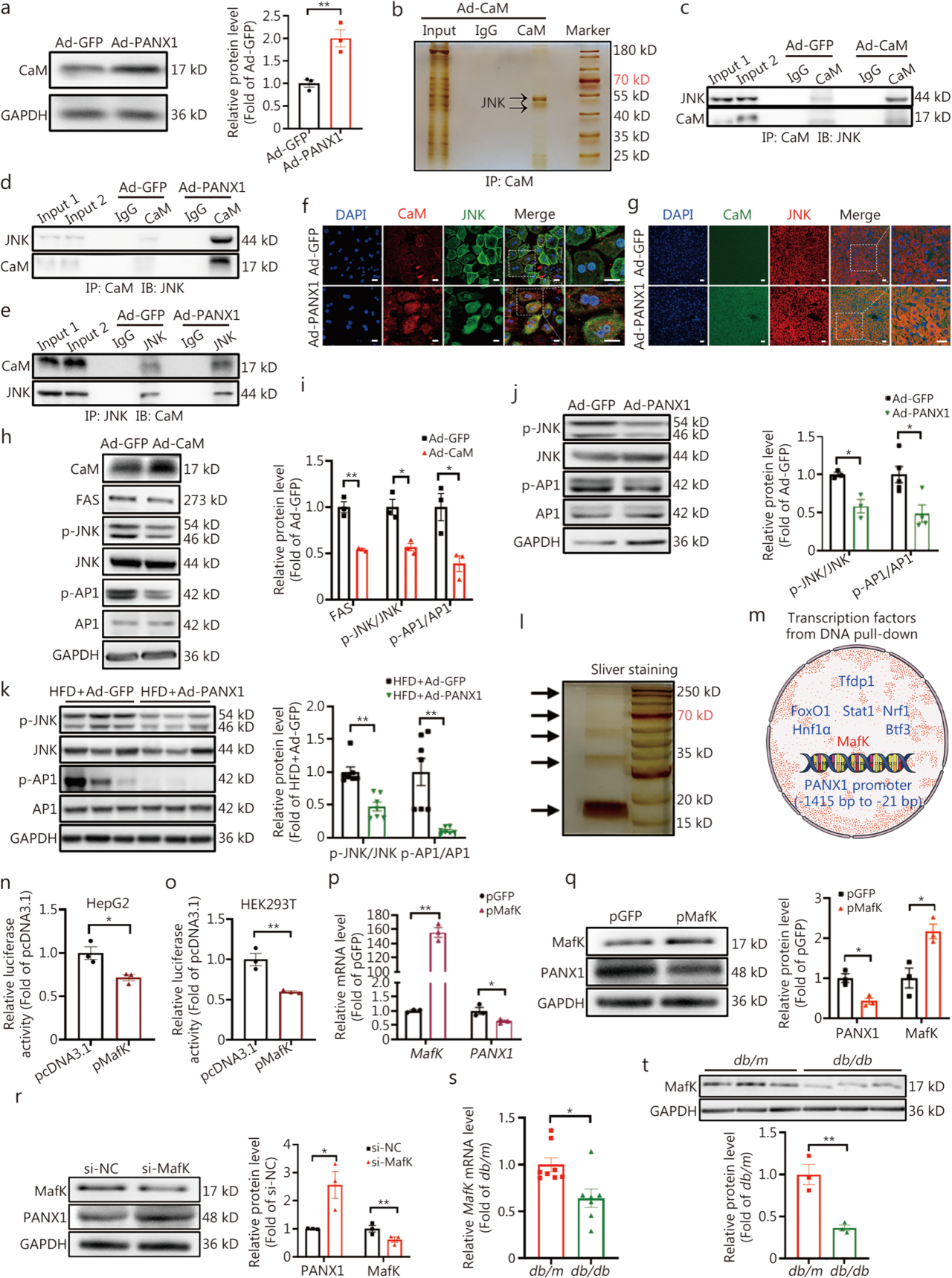
PANX1通过抑制JNK-AP1-FAS途径,改善肝脏脂质沉积
3、FAM3A介导的ATP释放依赖于PANX1
检测发现在小鼠和人肝细胞中,FAM3A过表达上调PANX1 mRNA及蛋白水平,为了确定FAM3A促进PANX1转录的机制,研究团队进行了生物信息学预测,在PANX1基因启动子区鉴定出参与肝脏糖脂代谢调节的转录因子HSF1的结合位点,并证实HSF1过表达可激活肝细胞中PANX1转录活性,增加其蛋白水平。此外,过表达FAM3A提高了小鼠和人肝细胞中HSF1的蛋白水平,用HSF1抑制剂KRIBB11处理可消除FAM3A诱导的PANX1蛋白水平的增加。随后,研究团队进一步证实FAM3A诱导的ATP的释放依赖于PANX1。为了进一步研究FAM3A对肝脏葡萄糖和脂质的调节作用是否依赖于PANX1,使用AAV-GFP作为对照,将AAV-FAM3A注射到PANX1缺陷小鼠的尾静脉中,发现FAM3A过表达未能改善PANX1缺陷小鼠的肝脏糖异生和脂质沉积,表明PANX1介导的ATP释放赋予FAM3A对肝脏糖脂代谢的调节作用。
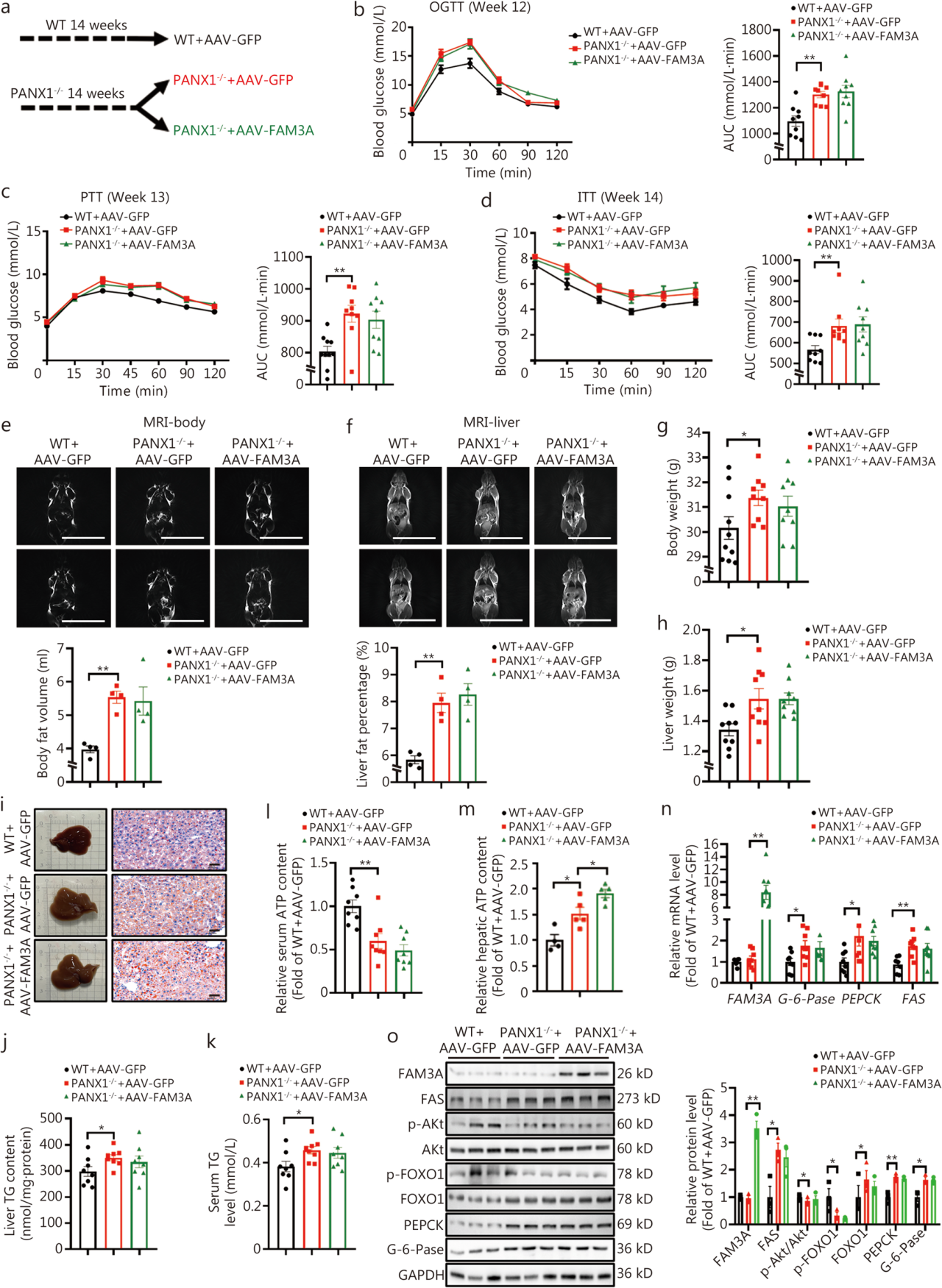
FAM3A过表达未能挽救PANX1缺陷小鼠的代谢紊乱
02
结论
本研究阐明PANX1介导的ATP释放对于抑制肝脏糖异生和脂肪生成至关重要。机制上,FAM3A激活HSF1以诱导PANX1表达,从而促进FAM3A诱导的ATP释放及其随后对肝细胞糖脂代谢的调节作用。研究结果揭示了非胰岛素依赖的FAM3A信号通路及网络作为代谢性疾病治疗的可行靶点,并为全面揭示FAM3A调控ATP合成释放缓解糖尿病及脂肪肝的机制提供了重要实验依据。
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









