 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
2024年5月,中南大学湘雅二医院金鑫联合华中科技大学同济医学院附属协和医院江科/唐露团队在Nature Communications上在线发表了文章“ZDHHC20-mediated S-palmitoylation of YTHDF3 stabilizes MYC mRNA to promote pancreatic cancer progression”。研究发现KRAS上调的蛋白ZDHHC20在胰腺癌中异常过表达,预示着不良预后;ZDHHC20通过Cys474的棕榈酰化抑制YTHDF3的溶酶体定位和降解,从而通过m6A修饰进一步调节MYC mRNA的稳定性,促进癌症细胞的恶性表型。本研究确定了ZDHHC20-YTHDF3-MYC轴以棕榈酰化依赖的方式促进胰腺癌进展的机制。

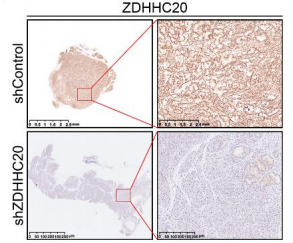
AAV-shControl和AAV-shZDHHC20感染KPC小鼠肿瘤组织的免疫组化染色
胰腺导管腺癌(Pancreatic ductal adencarcinoma, PDAC)是一种致死性实体肿瘤,在世界范围内发病率较高。由于PDAC缺乏早期诊断,且有转移和耐药倾向,因此PDAC的死亡率与发病率几乎相等。研究表明,KRAS突变是胰腺肿瘤发生的起始事件,常见的突变是KRAS G12D,发生在90%以上的胰腺上皮内瘤变(PanINs)中。在KRAS信号的背景下,PDAC中恶性转化和肿瘤维持的遗传控制在很大程度上仍未被探索。
1、KRAS突变通过STAT3诱导ZDHHC20在胰腺癌中积累
作者发现ZDHHC20在胰腺癌细胞系中的表达明显高于正常胰腺上皮组织,与其他胰腺癌细胞系相比,ZDHHC20在无KRAS突变的胰腺癌细胞系BxPC-3中的表达水平相对较低。此外,TIMER数据库分析显示,在KRAS突变的胰腺癌患者的肿瘤组织中,ZDHHC20的表达水平高于没有KRAS突变的胰腺癌患者。为了进一步研究KRAS突变是否导致ZDHHC20在胰腺癌组织中高表达,作者利用KRAS G12D抑制剂处理胰腺癌细胞,发现KRAS G12D抑制剂处理可显著下调胰腺癌细胞中ZDHHC20的表达。进一步研究KRAS调控ZDHHC20表达的机制,发现外源KRAS G12D的表达导致ZDHHC20显著上调。利用KnockTF平台分析发现STAT3对ZDHHC20具有显著调节作用,ChIP-qPCR结果表明STAT3可以结合到ZDHHC20的启动子区。此外,KRAS G12D的外源表达增强了ZDHHC20启动子区域STAT3的富集。以上表明KRAS突变是胰腺癌中STAT3-ZDHHC20轴过度激活的主要致病因素之一。

图1.KRAS突变通过STAT3诱导ZDHHC20在胰腺癌中积累
2、ZDHHC20以棕榈酰化依赖的方式促进胰腺癌进展
接下来,作者探究了ZDHHC20在胰腺癌细胞中的生物学功能。在PANC-1和AsPC-1细胞中特异性敲低ZDHHC20,发现ZDHHC20沉默可显著降低这些胰腺癌细胞株的增殖、侵袭和迁移。此外,通过细胞源异种移植(CDX)模型,发现ZDHHC20的敲低抑制了肿瘤的生长。作者利用AAV8-shZDHHC20在KPC小鼠中敲低ZDHHC20,发现在KPC小鼠中敲低ZDHHC20导致肿瘤重量降低,胰腺肿瘤病变面积减小,值得注意的是,小鼠存活时间延长,表明ZDHHC20在胰腺癌中作为肿瘤启动子起作用。考虑到ZDHHC20作为棕榈酰酰基转移酶的功能,作者探究了ZDHHC20的致癌能力是否依赖于其棕榈酰化活性,构建了两个没有明显催化活性的ZDHHC20突变体(C156S和F171A),发现这两个突变体的过表达显著降低了ZDHHC20的棕榈酰化催化活性,抑制了胰腺癌细胞的增殖和侵袭。表明ZDHHC20可能以部分依赖于棕榈酰化的方式促进胰腺癌的进展。
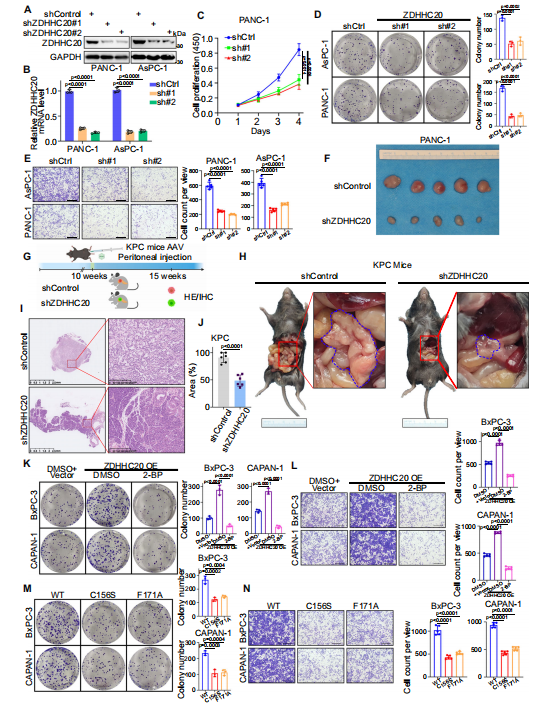
图2. ZDHHC20以棕榈酰化依赖的方式促进胰腺癌的进展
3、ZDHHC20通过Cys474上的棕榈酰化抑制YTHDF3的降解
作者进一步研究发现ZDHHC20是YTHDF3棕榈酰化酶,ZDHHC20介导的YTHDF3在Cys474上的棕榈酰化促进了胰腺癌的进展。为了更全面地了解YTHDF3棕榈酰化,作者评估了YTHDF3棕榈酰化修饰对其亚细胞定位的潜在影响。核/胞质分离实验表明,YTHDF3主要定位于细胞质中,这与之前的报道一致。下调ZDHHC20只降低了YTHDF3的蛋白水平,并没有改变YTHDF3的mRNA水平。作为一种可逆的翻译后修饰,棕榈酰化调节蛋白质的运输、相互作用和降解。接下来,作者评估了ZDHHC20棕榈酰化是否调节YTHDF3降解,发现ZDHHC20介导的YTHDF3-Cys474棕榈酰化抑制了HSC70对YTHDF3的识别,从而通过CMA途径抑制了其随后的溶酶体降解。
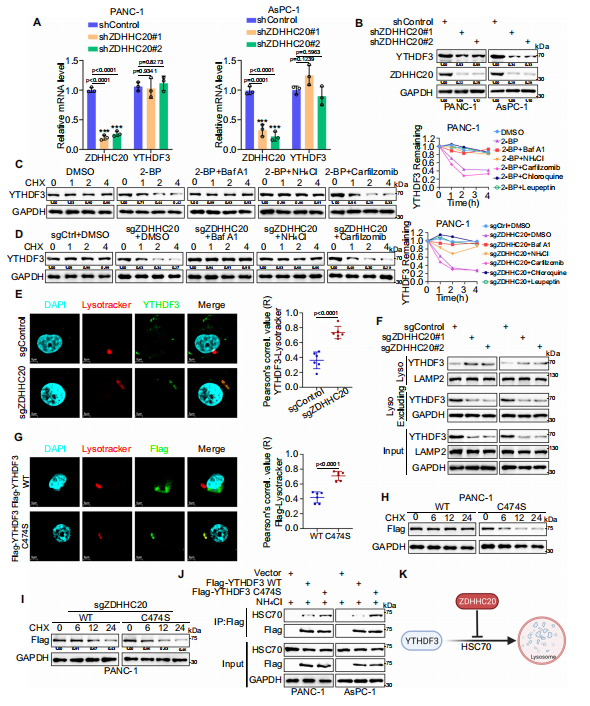
图3.ZDHHC20通过Cys474上的棕榈酰化抑制YTHDF3的降解
4、ZDHHC20介导的YTHDF3-Cys474棕榈酰化稳定MYC mRNA水平
作者探究了ZDHHC20-YTHDF3轴促进胰腺癌进展的机制,发现YTHDF3棕榈酰化与MYC表达密切相关。作为m6A的主要读取器之一,YTHDF3可识别m6A修饰的RNA,随后调控其稳定性和翻译,机制研究发现YTHDF3以依赖m6A的方式稳定MYC mRNA。接下来,作者探究了ZDHHC20是否通过影响MYC的生物学功能来促进胰腺癌的进展,评估2-BP处理和敲除ZDHHC20对MYC mRNA稳定性的影响,发现阻断YTHDF3 Cys474棕榈酰化可降低MYC mRNA的半衰期。WB结果表明,异位表达ZDHHC20上调MYC的表达,这一作用可被YTHDF3敲除阻断。MYC沉默在体外和体内逆转了异位ZDHHC20表达对PDAC的促进作用。以上结果表明,ZDHHC20介导的YTHDF3-Cys474棕榈酰化调节MYC mRNA的稳定性,促进PDAC的进展。治疗性阻断ZDHHC20-YTHDF3相互作用可抑制胰腺癌进展。
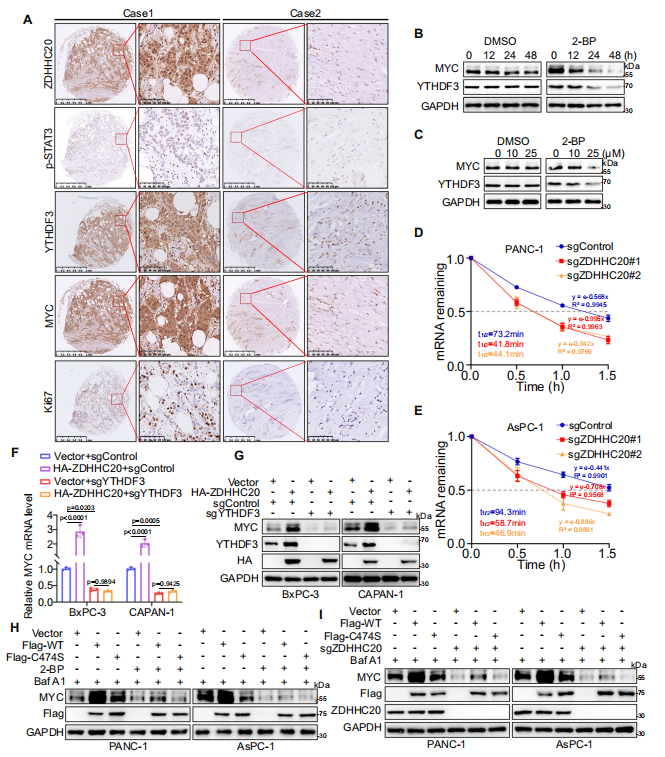
图4. ZDHHC20介导的YTHDF3-Cys474棕榈酰化稳定MYC mRNA水平
综上,KRAS上调的ZDHHC20在胰腺癌患者中异常过表达并与不良预后相关。ZDHHC20表达失调以棕榈酰化依赖的方式促进胰腺癌的进展,ZDHHC20通过Cys474的S-棕榈酰化抑制伴侣蛋白介导的YTHDF3自噬,导致致癌产物MYC的异常积累,从而促进癌细胞的恶性表型。以上发现还确定了YTHDF3作为m6A读取器的致癌作用,并强调了靶向ZDHHC20-YTHDF3-MYC信号轴在胰腺癌中的治疗潜力。