IF 12.4!南京师范大学郭志刚/胡志刚教授团队发现APE1在HCC铁死亡调控中的作用机制
肝细胞癌(HCC)是癌症相关死亡的主要原因之一,目前的治疗措施仍不能有效改善HCC患者的总生存率。铁死亡是由铁依赖性脂质过氧化引发的一种细胞死亡形式,已成为一种有前途的癌症治疗策略,尤其是在HCC中。然而,HCC中铁死亡调节的机制尚不清楚。2024年2月28日,南京师范大学郭志刚/胡志刚教授团队在Cell Death and Differentiation (IF 12.4)发表题为“APE1 inhibition enhances ferroptotic cell death and contributes to hepatocellular carcinoma therapy”的研究论文。研究揭示了多功能酶APE1在铁死亡调节中的新作用和机制,并强调了靶向APE1作为HCC和其他癌症治疗策略的潜力。
本研究所用NRF2、siAKT及siGSK3β质粒、APE1干扰慢病毒由维真助力提供!
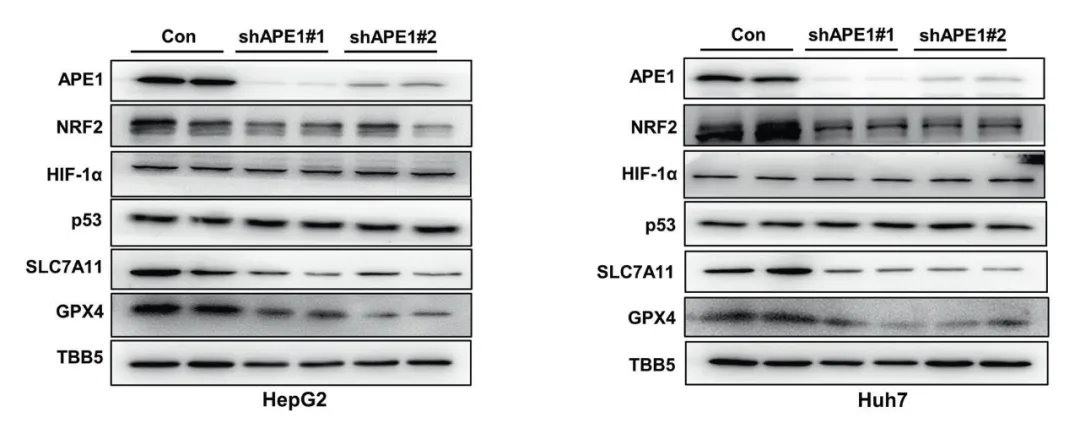
HCC细胞系中Lv-shAPE1的表达效果
研究结果
1、抑制APE1促进HCC细胞铁死亡
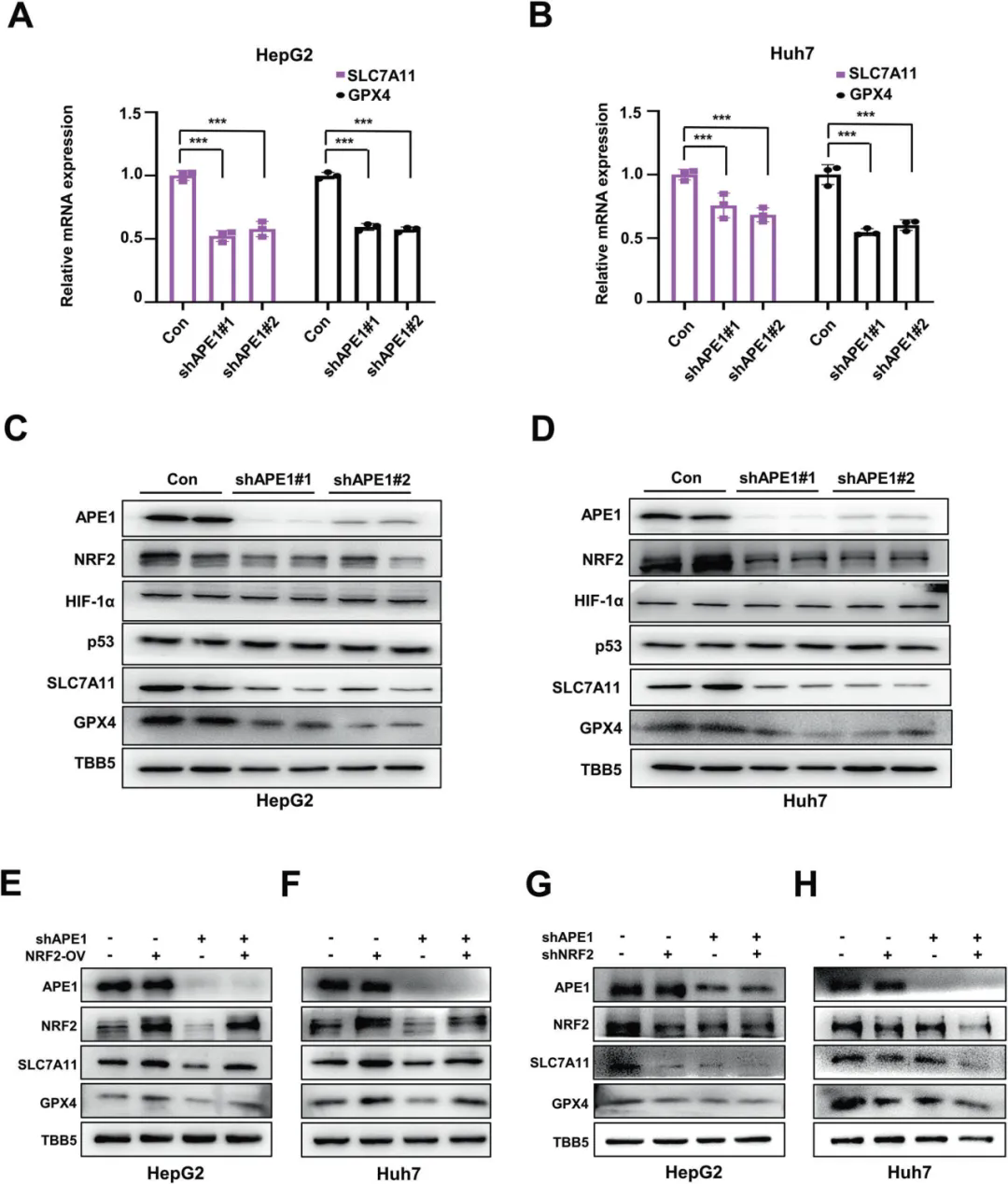
最近的多项研究表明铁死亡与HCC的发展和治疗反应有关,同时脱嘌呤/脱嘧啶核酸内切酶1,APE1在HCC中高水平表达,促进HCC的进展并与其不良预后相关,鉴于此,作者探索了APE1是否参与HCC的铁死亡。首先,通过建立APE1敲低(APE1-KD)的HCC细胞系,发现APE1的沉默促进了HCC细胞的铁死亡,进而检测参与铁死亡途径关键基因的表达,证实APE1通过NRF2/SLC7111/GPX4轴调节铁死亡。
接下来,作者研究了APE1调节NRF2的具体机制,发现APE1的敲低并不影响HCC细胞中NRF2的mRNA水平,而是影响其蛋白水平。抑制APE1显著下调了糖原合成酶激酶-3β(GSK3β)的磷酸化水平,此外,NRF2的泛素化水平在APE1-KD细胞中上调,但在使用GSK3β抑制剂处理后得到逆转,表明APE1沉默通过GSK3β促进NRF2泛素化。进一步的分析表明APE1通过AKT影响GSK3β活性,从而调节NRF2的稳定性,参与铁死亡。
APE1通过NRF2/SLC7A11/GPX4轴调控铁死亡
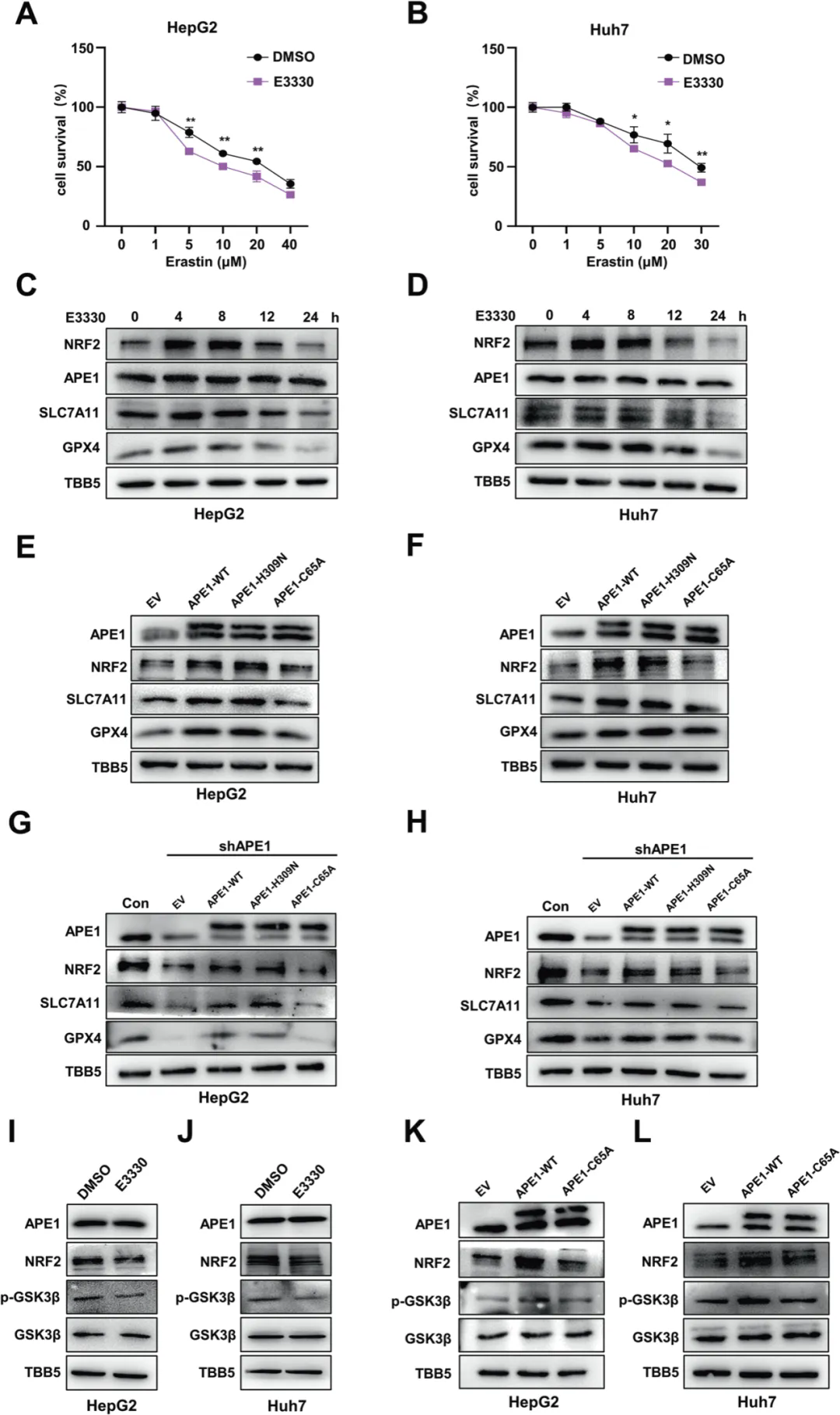
2、APE1调节铁死亡依赖于其氧化还原功能
通过在对照或APE1-KD HCC细胞中过表达或敲低NRF2,证实沉默APE1增强的铁死亡依赖于NRF2。由于APE1同时具有DNA修复功能和氧化还原调节功能,因此需明确具体哪种功能参与铁死亡的调节,数据显示敲低APE1或使用CRT(APE1 DNA损伤修复功能抑制剂)增加了HCC细胞中的γ-H2AX(DNA损伤标记物)水平,然而Ferr-1处理不影响APE1敲低细胞或CRT处理的细胞和对照细胞中的γ-H2AX水平,以及DNA损伤反应信号水平;将CRT与erastin、RSL3联合处理HCC细胞,发现CRT对erastin或RSL3诱导的HCC细胞铁死亡没有影响,表明抑制APE1增强的铁死亡与其DNA修复功能无关。随后用E3330(APE1 氧化还原功能抑制剂)处理HCC细胞,增强了erastin和RSL3诱导的细胞死亡,同时下调了HCC细胞中SLC7A11和GPX4的mRNA和蛋白水平,以及NRF2的蛋白水平。通过构建APE1的DNA损伤修复功能突变体和氧化还原功能突变体,进一步表明APE1通过其氧化还原功能调节GSK3β的磷酸化,从而影响NRF2的稳定性,并调节参与铁死亡的SLC7A11和GPX4的表达。
APE1依靠其氧化还原功能参与铁死亡
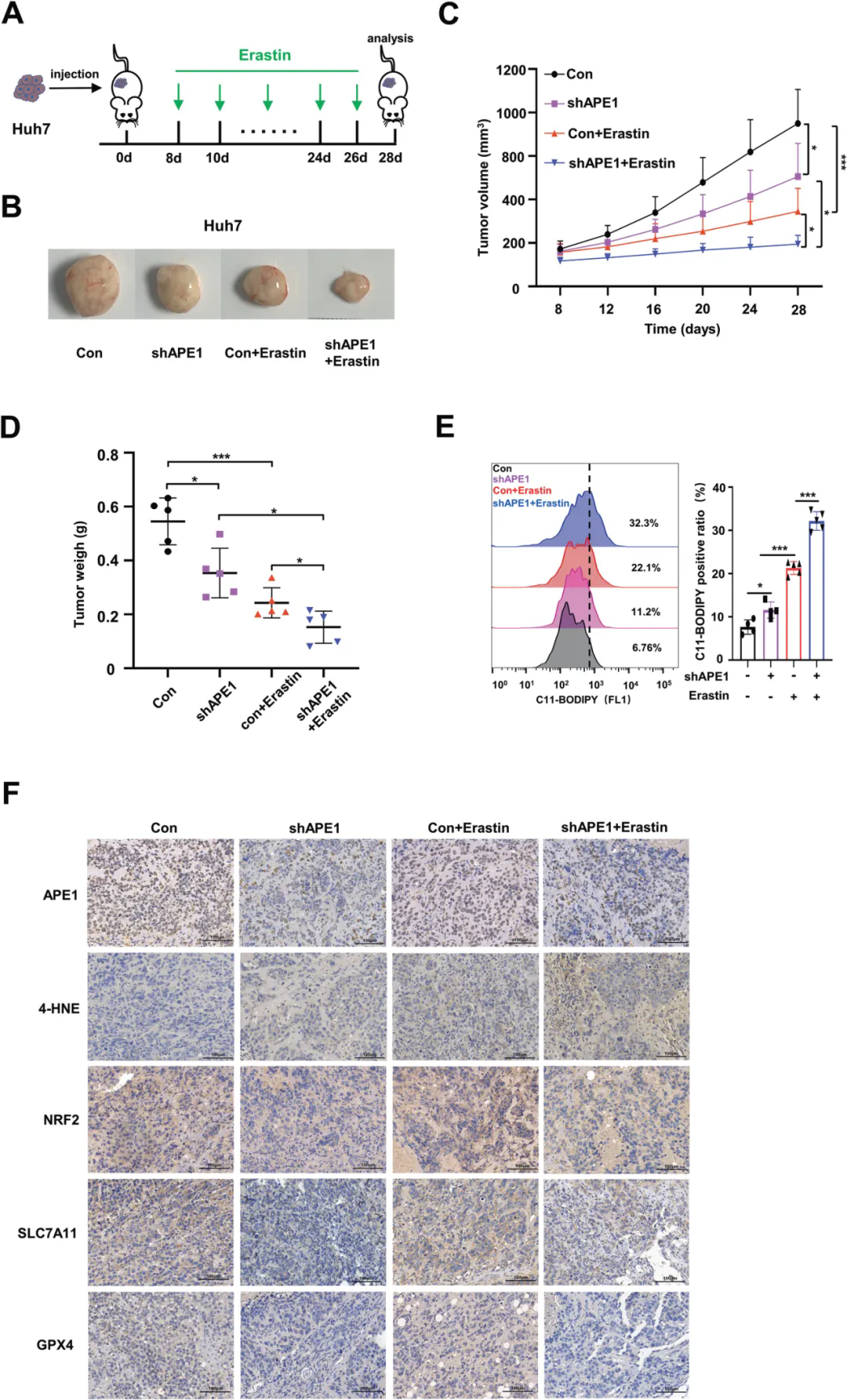
3、抑制APE1增强了HCC对铁死亡的敏感性
作者在裸鼠中建立了APE1-KD Huh7衍生的异种移植物模型,以进一步研究APE1抑制对体内HCC铁死亡的影响。与对照组相比,APE1-KD和erastin联合处理提高了治疗效果;通过流式细胞术检测发现APE1的沉默上调了肿瘤组织中由erastin诱导的脂质过氧化水平。IHC染色和WB实验表明,erastin处理增加了SLC7A11和CHAC1的蛋白质水平,表明erastin对小鼠的治疗是有效的。此外,与野生型Huh7来源的肿瘤组织相比,APE1-KD Huh7细胞来源的肿瘤细胞组织中的NRF2、SLC7A11和GPX4蛋白水平降低,并且APE1的敲低显著上调了erastin诱导的4-HNE在肿瘤组织中的积累。上述结果表明APE1缺失增强了erastin在体内对HCC的治疗作用。
沉默APE1增强HCC对体内铁死亡的敏感性
结论
研究表明抑制APE1可促进HCC细胞中的铁死亡,揭示了APE1在调节肝癌细胞铁死亡中的重要作用和具体机制,为肝细胞癌的治疗提供了新靶点和新思路。
 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯