 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
作为大脑中的一种主要神经元类型,兴奋性神经元(EN)调节秀丽隐杆线虫的寿命。然而,EN是如何衰老的尚不清楚。2023年11月,浙江大学基础医学院与附属邵逸夫医院赵经纬教授团队,与复旦大学脑科学转化研究院舒友生教授及深圳华大生命科学研究院韩磊博士等合作在Nature Communications(IF16.6)在线发表题为“GDF11 slows excitatory neuronal senescence and brain ageing by repressing p21”的研究论文。本研究发现生长分化因子11(GDF11)缺失通过Smad2诱导的促衰老因子p21的转录来诱导神经元衰老,揭示了GDF11延缓兴奋性神经元衰老、脑老化和维持寿命的分子机制。
研究结果
作者首先确认了GDF11主要在成年小鼠、狨猴和人脑的兴奋性神经元(EN)中表达,并且GDF11在EN中的表达随自然衰老进程而降低。为研究兴奋性神经元中内源性GDF11与神经元衰老之间的关系,研究人员通过选择性地删除小鼠中枢神经系统EN中的GDF11,构建了GDF11cKO小鼠。结果显示,中枢神经系统EN中GDF11的缺失会优先诱导特定脑区(扣带回、岛叶和梨状皮层)的细胞衰老,主要衰老细胞是兴奋性神经元,表明EN中内源性GDF11是其维持年轻状态所必需的。此外,相对于对照小鼠,GDF11cKO小鼠的寿命缩短10%,证明兴奋性神经元中的GDF11在脑衰老甚至全身衰老中发挥着至关重要的作用。体外实验中,研究人员利用CRISPR/Cas9技术在Neuro-2a细胞中敲除GDF11,结果发现敲除GDF11加快细胞衰老,体内和体外实验得到一致的结果。
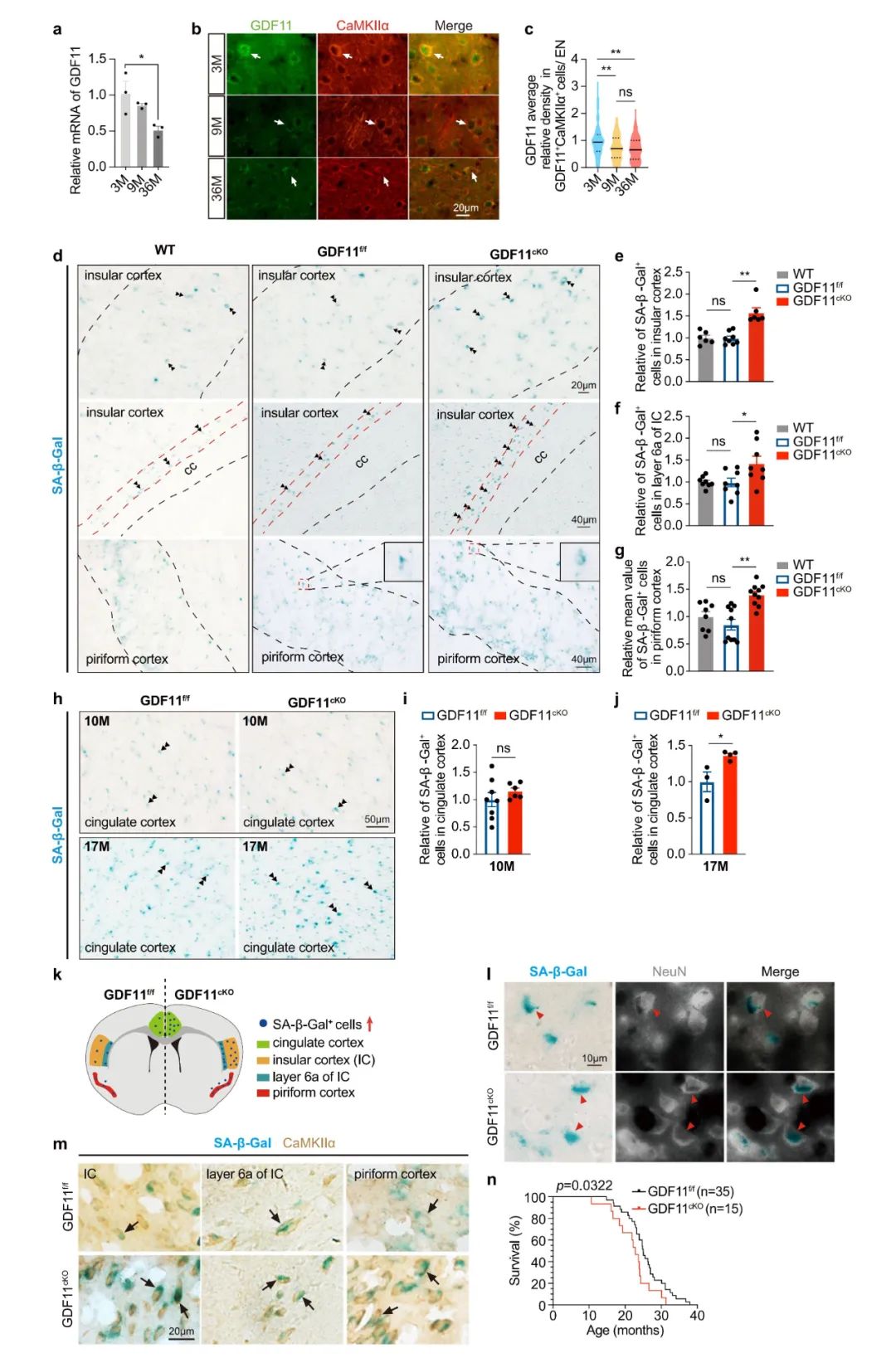
图1.兴奋性神经元中GDF11的缺失导致细胞衰老和大脑老化
02 兴奋性神经元GDF11的缺失损害认知和记忆
为探究兴奋性神经元中内源性GDF11与神经元衰老之间的关系,研究人员采用Cre/loxp策略,通过向GDF11f/f小鼠的扣带回皮层(Cg2)中注射AAV9-CaMKIIα-Cre-EGFP病毒,在小鼠扣带回兴奋性神经元中特异性敲除GDF11。结果显示,敲除GDF11后,EN自身的兴奋性增强,其接收的抑制性输入减少,但增加了兴奋性输入,这种动态平衡最终导致神经元的过度兴奋。行为学测试揭示局部性和系统性的GDF11缺失都会使小鼠的社交能力、社会记忆和物体识别记忆恶化,这表明通过敲除GDF11诱导EN细胞衰老足以引起认知能力下降。
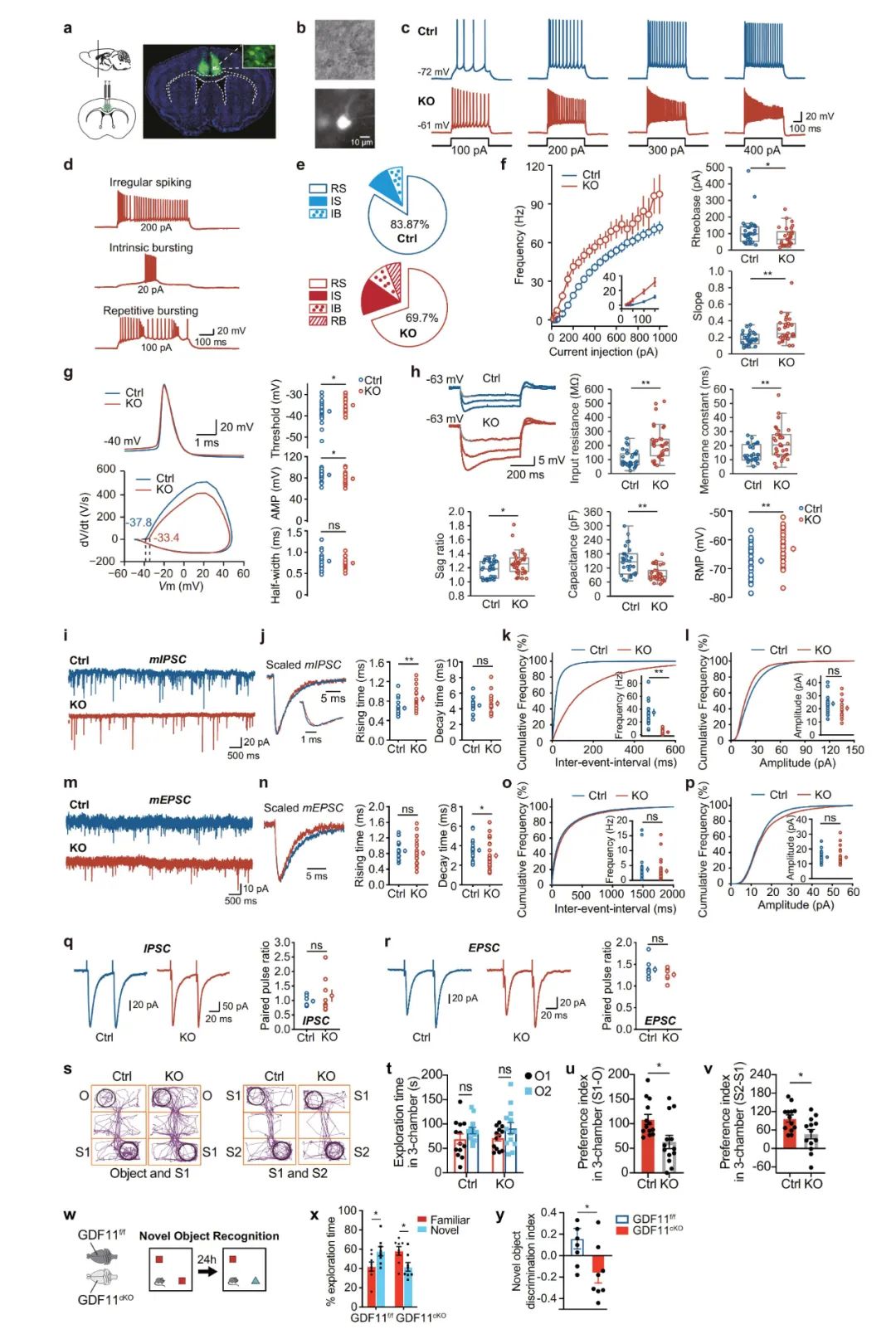
图2.兴奋性神经元中GDF11的缺失会损害认知和记忆
03 p21是体内兴奋性神经元GDF11缺失诱导衰老所必需的
研究人员进一步探究了体内GDF11缺失诱导的EN加速衰老的细胞通路,发现敲除GDF11影响衰老相关基因的表达和衰老相关的生物学过程,且显著上调促衰老关键因子p21。为研究EN诱导的EN衰老中GDF11的缺失是否也需要p21,生成了GDF11和p21双敲除小鼠,进一步验证了p21在GDF11缺失诱导的EN衰老中是必需的。机制上,GDF11敲除上调Smad2磷酸化,促进Smad2/3复合体进入细胞核,然后Smad2结合p21启动子并促进p21的转录,以诱导兴奋性神经元衰老。
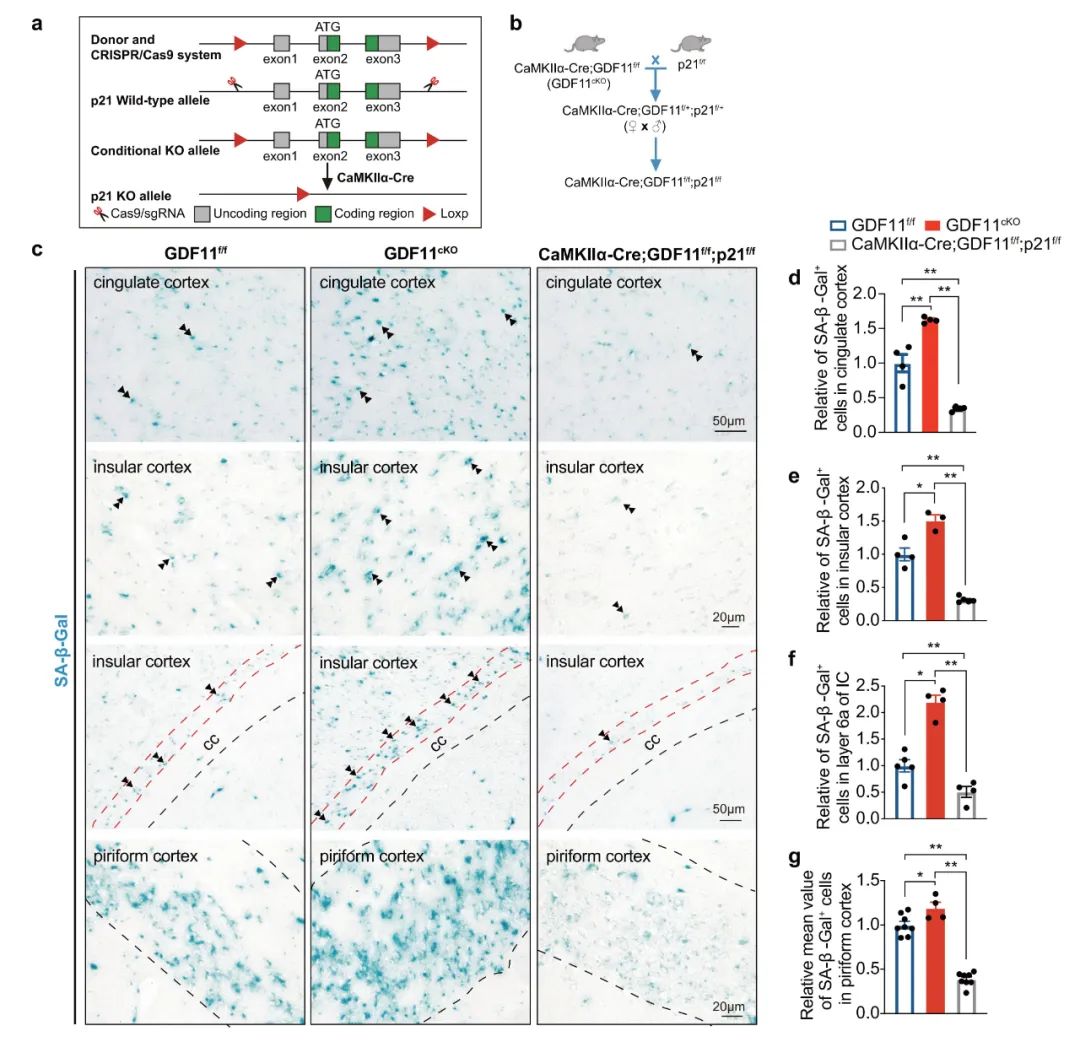
图3.p21是体内兴奋性神经元GDF11缺失诱导衰老所必需的
结论
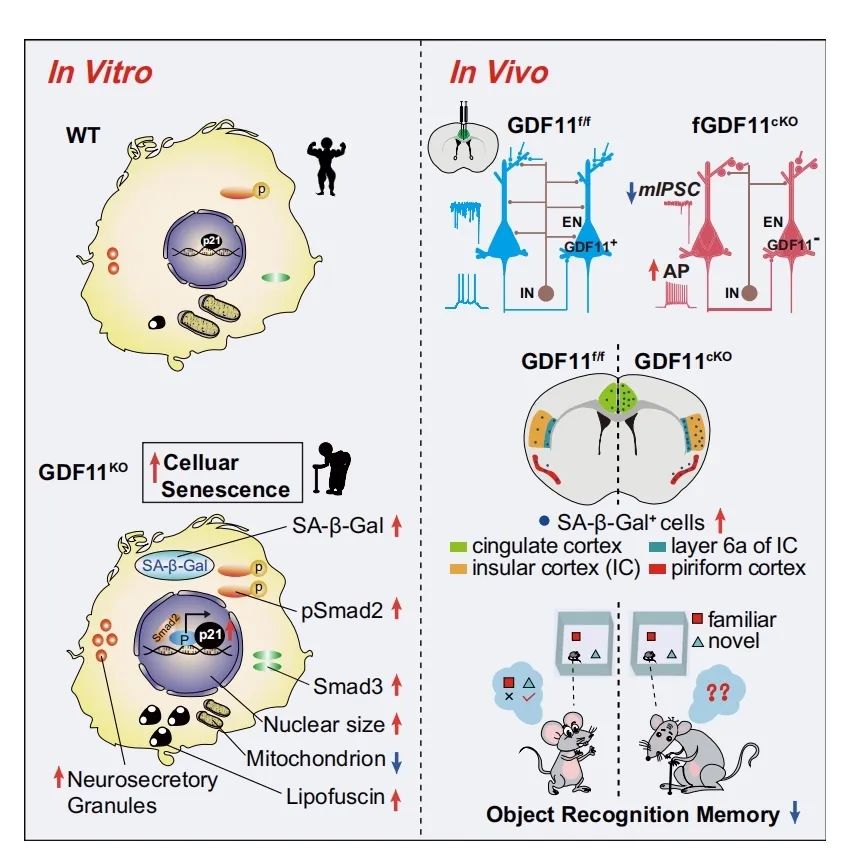
本研究表明GDF11的缺失促进通过Smad2诱导的p21上调,导致神经元衰老以及脑衰老,并影响认知功能和小鼠寿命,揭示了GDF11延缓兴奋性神经元衰老、脑老化和维持寿命的分子机制。
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









