 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯


研究方法与结果
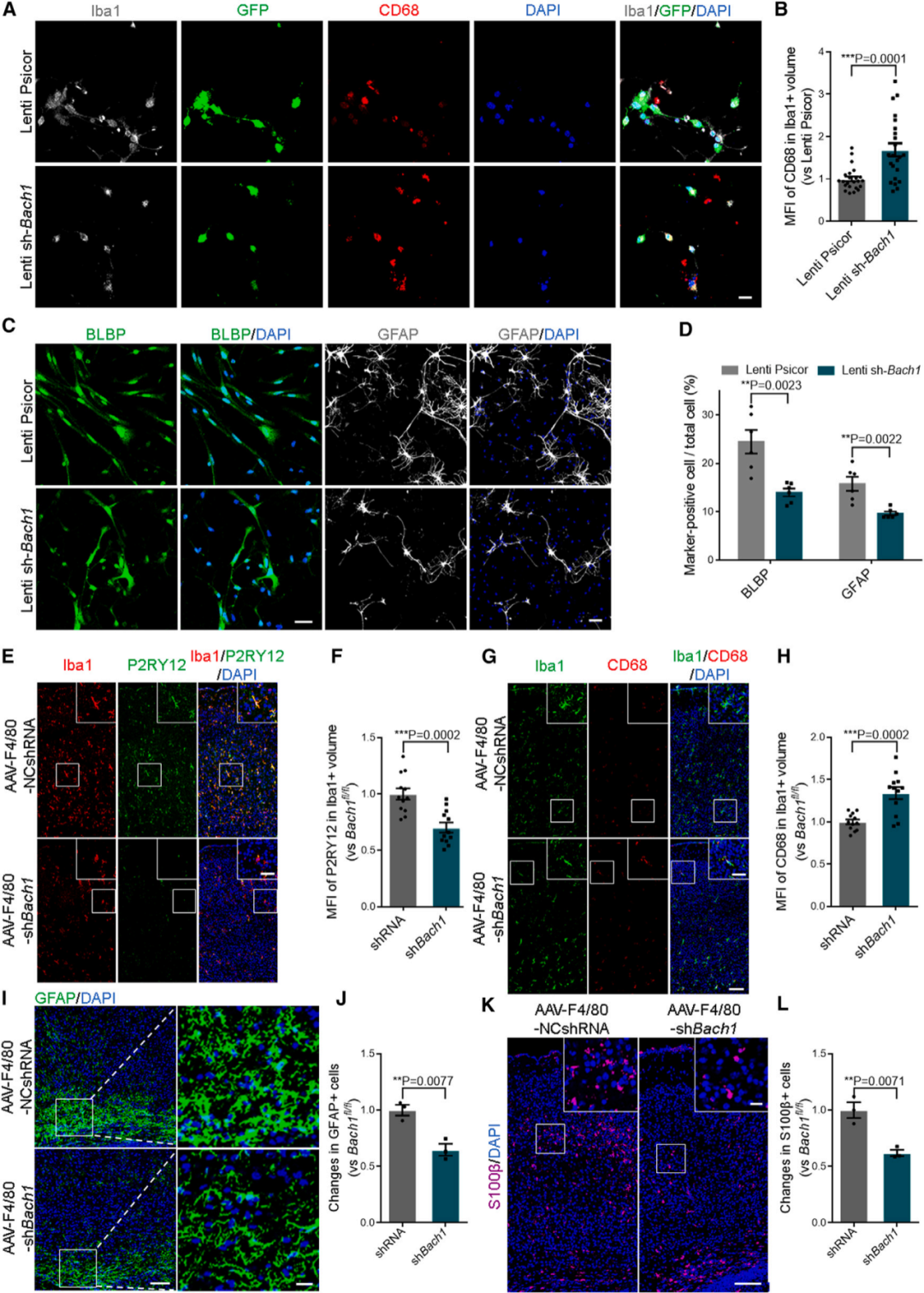
体内外小胶质细胞BACH1缺失损害小胶质细胞稳态和星形细胞生成
进一步分析发现,皮质发育过程中小胶质细胞代谢紊乱损害神经祖细胞(NPC)的增殖和分化。接下来,研究人员对Bach1cKO-Cx3小鼠及其同窝Bach1fl/fl小鼠进行一系列行为实验,结果表明小胶质细胞Bach1缺乏导致小鼠出现焦虑样行为,如探索能力受损和社交障碍,但不会导致抑郁样行为和工作记忆缺陷。研究表明,Bach1参与调节癌症细胞有氧糖酵解途径中关键酶的表达,通过免疫共沉淀实验发现小胶质细胞源性的Bach1缺失限制糖酵解过程中两个关键限速酶Hk2和Gapdh的转录来减少乳酸的产生。进一步通过RNA-seq筛选到Bach1的潜在下游靶点Lrrc15;通过筛选常见的乳酸化修饰位点(H4K12la,H4K5la和H3K18la)后发现,小胶质细胞Bach1缺失引起的乳酸减少导致Lrrc15启动子处H4K12la富集减少,从而抑制转录。

BACH1通过靶向小胶质细胞LRRC15调节星形细胞生成
为了探索小胶质细胞Bach1缺失引起星形细胞发生功能障碍的分子机制,研究人员对RNA-seq数据集进行了分析,并确定了突变小胶质细胞中涉及配体-受体相互作用的潜在反应。先前的研究表明,CD248在肿瘤微环境中与LRRC15共表达,并可能作为LRRC15的未知受体,在此研究人员通过共免疫沉淀确定了LRRC15和CD248之间存在直接相互作用,同时检测到Bach1cKO-Cx3小鼠星形细胞祖细胞中p-JAK1/2和p-STAT3水平降低。进一步分析确定了小胶质细胞衍生的LRRC15通过与CD248相互作用来激活GP130-JAK-STAT3通路,从而调控星形胶质细胞发生,并且通过补充外源性LRRC15可以挽救小胶质细胞Bach1缺乏引起的发育障碍。以上数据说明LRRC15通过CD248-GP130-JAK-STAT3信号转导参与星形细胞发生并挽救BACH1缺失造成的发育缺陷。

小结
本研究阐明了Bach1缺陷小胶质细胞的代谢紊乱导致HK412la位点下游靶标Lrrc15的乳酸修饰减少,确定了由LRRC15-CD48-JAK/STAT3轴介导的小胶质细胞-星形胶质细胞通讯,并在Bach1cKO-Cx3小鼠中诱导焦虑样行为,为小胶质细胞代谢稳态、小胶质细胞-星形胶质细胞通讯和焦虑样行为提供了见解。

备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









