 当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
蛋白磷酸化攻略大全
前几日,我们为大家介绍了关于反相蛋白微阵列RPPA的有关知识(『江湖召集令』癌症相关蛋白及磷酸化水平大数据等你来分析!),利用RPPA技术可以同时分析成百上千种细胞或者组织样本中不同蛋白的表达情况,包含修饰后蛋白(如磷酸化、甲基化、乙酰基化)的差异表达比对分析,那么,关于蛋白质翻译后修饰你了解多少呢,蛋白质磷酸化究竟又是怎么一回事?今天,小V就和大家一起来探索有关蛋白质磷酸化的那些事儿!
蛋白质翻译后修饰(PTMs)在生命体中具有十分重要的作用,它使蛋白质的结构更复杂,功能更完善,调节更精细,作用更专一。蛋白翻译后修饰包括:磷酸化、糖基化、甲基化、羟基化、脂酰化、羧基化等共价修饰。其中,蛋白磷酸化是非常常见和非常重要的翻译后修饰之一,它在每个生物的各个方面都扮演着重要的角色,例如基因转录、表达、细胞增殖、分化、凋亡、信号转导、免疫调控、肿瘤发生等。
一.蛋白磷酸化简介
蛋白磷酸化是在酶的催化作用下,将ATP γ位的磷酸基团,转移至蛋白质氨基酸侧链上的过程。该过程是可逆的,催化蛋白质发生磷酸化的酶被称为蛋白激酶(protein kinase, PK),而催化蛋白质去磷酸化的酶被称为蛋白磷酸酶(protein phosphatase, PPase)(图1)。蛋白磷酸化是调节和控制蛋白质活性和功能的重要机制。
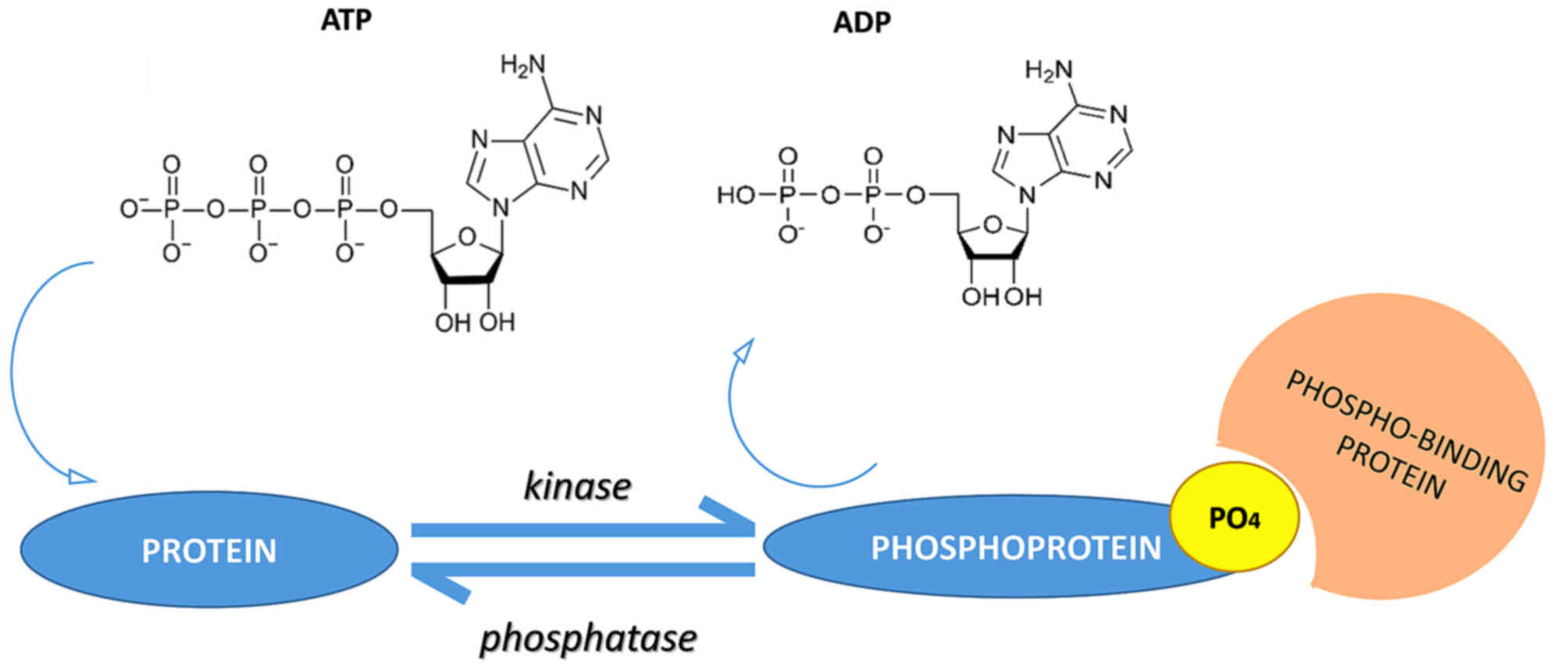
图1:蛋白质磷酸化和去磷酸化的过程(图片来源于网络)
二.蛋白磷酸化分类及位点
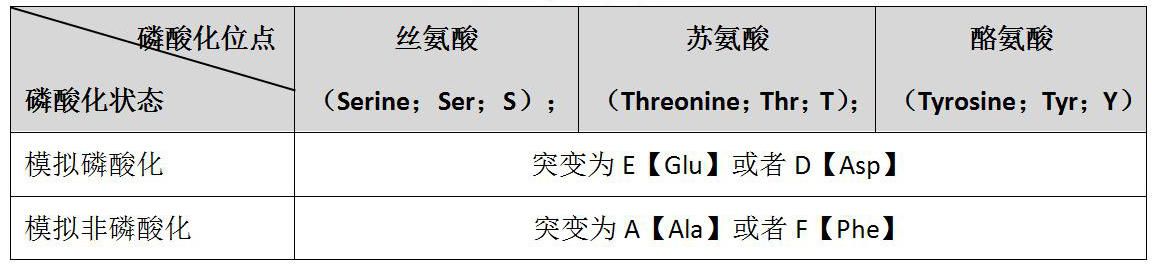
蛋白磷酸化是生物体内普遍存在的一种调节方式。据报道,人类基因组编码的21000个蛋白质中,90%以上发生了磷酸化。根据被磷酸化的氨基酸残基不同,蛋白质磷酸化可分为 4 大类,具体分类和磷酸化位点见表1,磷酸化的9个氨基酸分子式见图2。超过三分之一的蛋白磷酸化发生在丝氨酸、苏氨酸和酪氨酸残基上:其中丝氨酸残基最多(86.4%),其次是苏氨酸残基(11.8%),酪氨酸残基最少(1.8%)。丝氨酸、苏氨酸和酪氨酸的磷酸化组成了O-磷酸化。O-磷酸化在酸性条件下非常稳定,因此在细胞生物学和磷酸化蛋白质组学中研究广泛。而N-磷酸化由于不稳定导致其检测极具挑战性。加之,催化N-磷酸化的蛋白激酶和蛋白磷酸酶的缺乏进一步限制了它的研究。其他两类磷酸化(S-磷酸化和酰基磷酸化)的研究报道却少之又少。
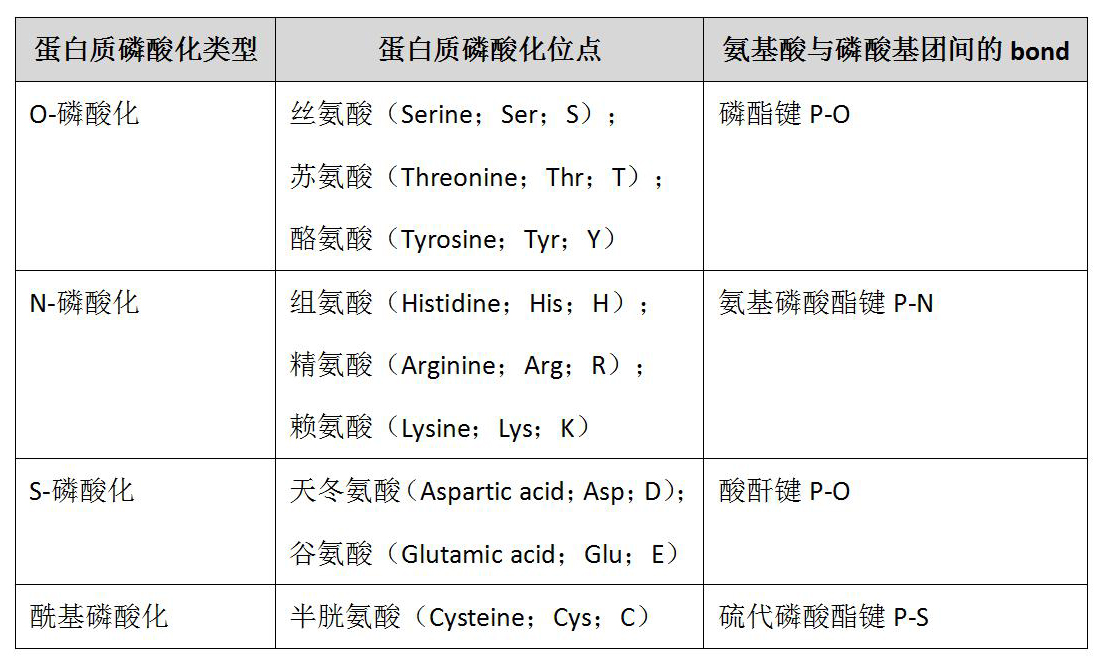
表1:蛋白磷酸化类型及位点
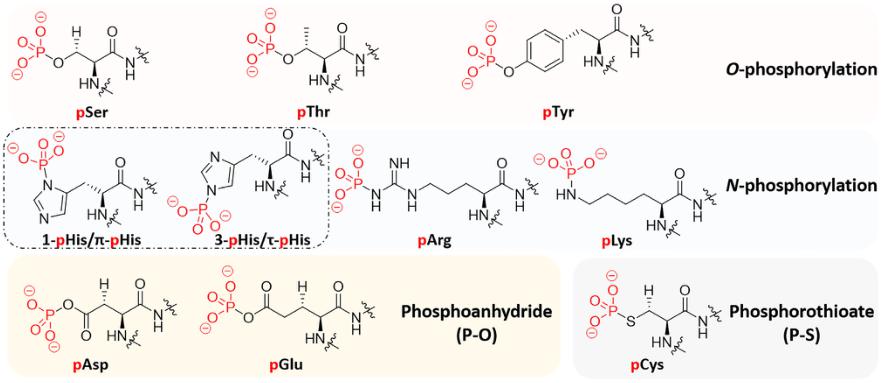
图2:磷酸化的9个氨基酸分子式
(B. Huang et al. International Journal of Biological Macromolecules 145 .2020)
三.蛋白磷酸化相关酶
人类基因组中约有500多种激酶和200多种磷酸酶能调控蛋白的磷酸化过程,这使得蛋白磷酸化更为复杂,这些磷酸化相关酶在精细调控生物体的众多细胞过程中可发挥关键作用。
四.蛋白磷酸化的检测方法
蛋白质磷酸化的分析和磷酸化位点的鉴定已成为目前蛋白质组学研究的关注点之一。目前蛋白质磷酸化的检测方法主要有特异性抗体(如western blot)、p32放射性标记、质谱、化学生物相结合、核磁共振等。每种方法有其各自的优缺点(表2),研究人员可根据实验设计挑选合适的检测方法。
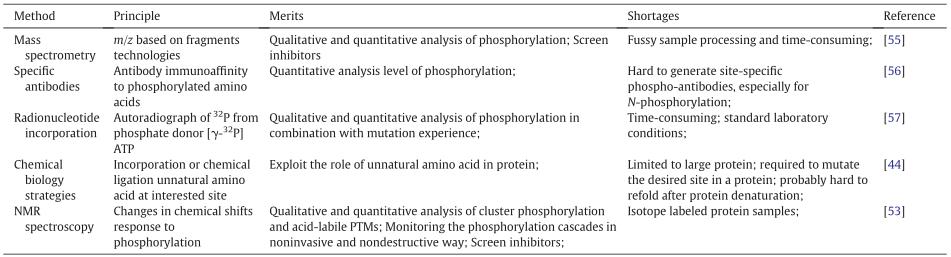
表2:蛋白质磷酸化检测方法的比较
(B. Huang et al. International Journal of Biological Macromolecules 145 .2020)
五.定点突变在蛋白磷酸化研究中的作用
定点突变可以随心所欲地改变已知DNA序列中的碱基。在基础研究中,科研工作者通常需要通过改变DNA序列获得突变基因,以研究基因结构与功能之间的关系;或者通过改变氨基酸序列获得突变蛋白,以研究蛋白质结构和功能的关系,从微观水平阐明生理状态下基因的调控机理、疾病的病因和发病机制。在磷酸化蛋白的研究中,构建模拟磷酸化和非磷酸化的突变实验是研究磷酸化功能效应的一种常用方法。
1. 磷酸化位点的查找
磷酸化定点突变实验的第一步首先要查找磷酸化位点。我们以常用的蛋白数据库UniProt为例说明,具体步骤如下:
(1)通过https://www.uniprot.org/链接进入UniProt官网,进入如下主界面:
(2)以人源p53蛋白为例,在Search栏(见上图红色标记位置)中输入p53,进入如下界面:
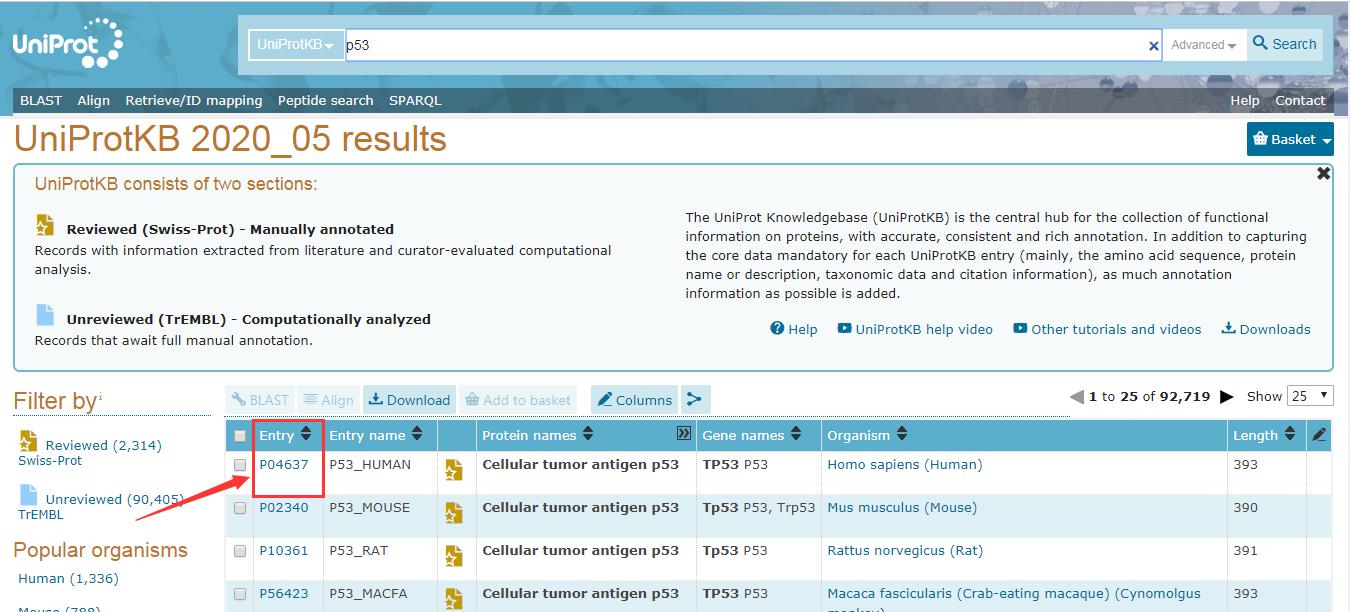


六.应用实例
实例一 蛋白磷酸化与肝自噬
2018年10月,浙江大学医学院刘教授课题组在Molecular Cell(IF=15.584)杂志发表了题为“mTORC1-Regulated and HUWE1-Mediated WIPI2 Degradation Controls Autophagy Flux”研究论文,该论文从采用质谱确定WIPI2新的互作蛋白出发,经体内外实验发现mTORC1 & WIPI2 &HUWE1三者之间的调控关系、功能效应、生物效应和生理功能:WIPI2是mTORC1新的磷酸化底物。mTORC1通过磷酸化WIPI2,促进WIPI2与其E3泛素连接酶HUWE1的相互作用,导致WIPI2的泛素化和经蛋白酶体的降解,最终抑制自噬,调控模型示意图见图3。
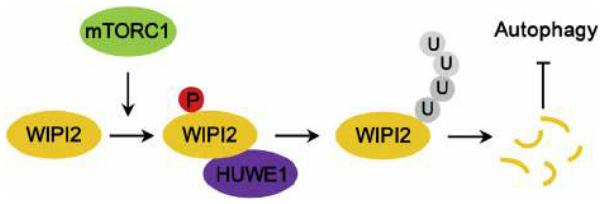
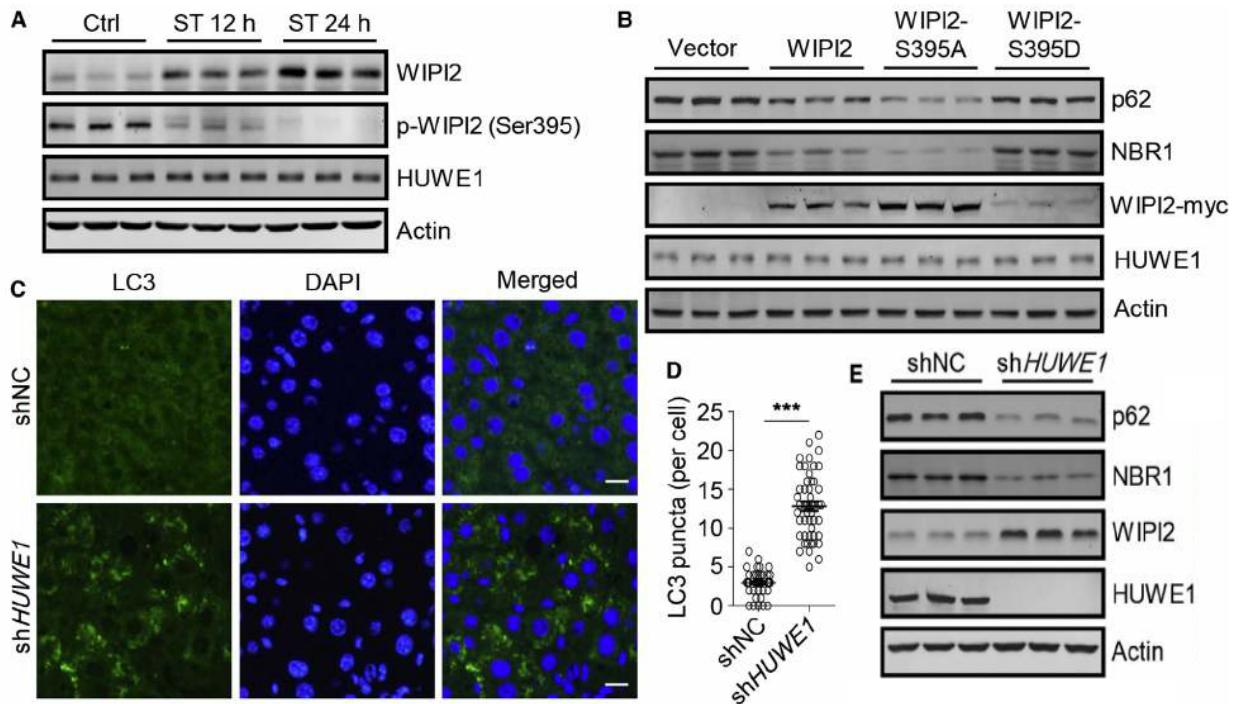

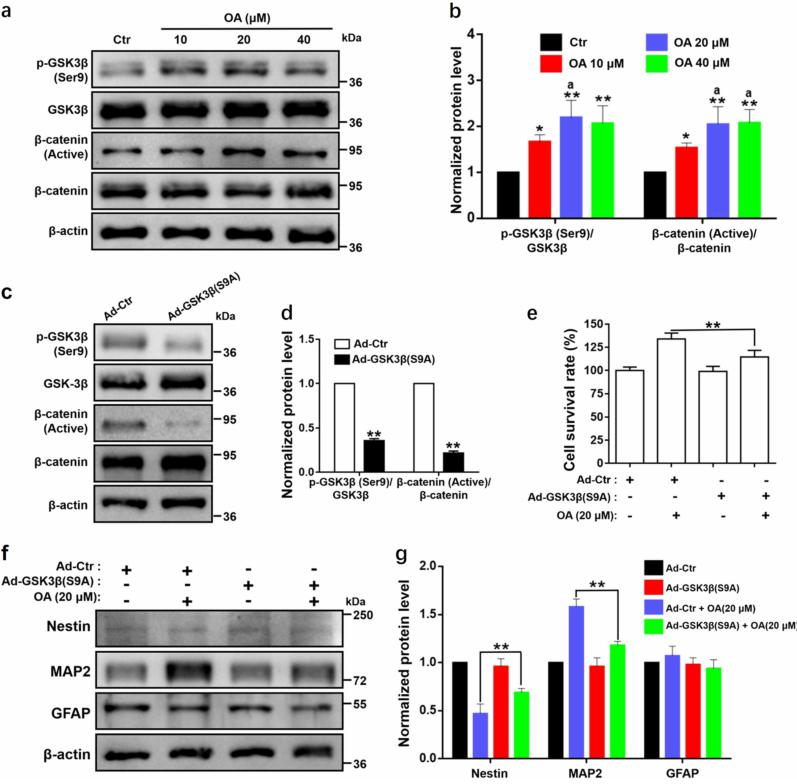
图5:齐墩果酸(OA)通过抑制GSK3β活性促进神经干细胞的增殖和分化
[注:Nestin (NSCs marker);MAP2 (microtubule-associated protein-2, neuron marker);GFAP(astrocytes marker)]

维真生物助力蛋白质磷酸化研究
