Cell Reports ‖ 维真AAV在慢性疼痛中的应用

1. 研究背景
疼痛是一种常见的临床症状,根据疼痛持续的时间和性质,可分为急性疼痛和慢性疼痛。急性疼痛是一种机体提示组织损伤的警示信号,而慢性疼痛却是一种病理的,涉及到外周和中枢系统可塑性改变的过程,它包含了多个行为维度的改变,如自发性疼痛、温度和机械刺激导致的诱发痛敏、负性情绪和认知功能障碍等多种行为异常。流行病学调查显示,慢性疼痛的发病率高达19%,严重影响患者工作能力和生活质量。
自发性疼痛是慢性痛患者的重要主诉,然而,由于实验动物无法直接地表达疼痛水平,使得动物模型上的疼痛机制研究多集中于诱发痛,而非临床意义更大的自发痛。这也是诸多在动物模型上效果显著的新型镇痛药屡屡在临床试验中失败的重要原因之一。脑功能成像研究初步提示,经典的“痛矩阵”脑区主要与诱发痛相关,而自发痛更多伴随边缘系统脑区功能变化,这提示二者机制可能有所不同。本研究旨在研究自发性疼痛的中枢神经机制。
本研究成果于2019年11月发表在《Cell Reports》上(IF: 7.815)。
扫码查看文章
2. 研究思路
首先,研究者采用行为学的方法检测了慢性炎症痛大鼠在整个炎症痛病程中的多个维度的行为特征;其次,通过在体电生理记录的方法,记录了腹侧海马CA1(ventral CA1,vCA1)和前额叶的边缘下皮层亚区(infralimbic cortex,IL)在整个炎症痛病程中的电生理功能特性;最后,利用光/化学遗传/脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)过量表达的手段,特异性激活该通路的投射,增强其功能连接性,观察腹侧海马到前额叶边缘下皮层通路对自发痛行为的影响。
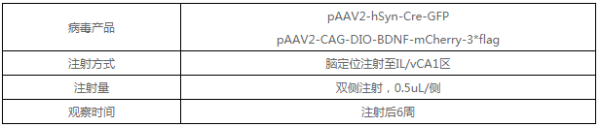
3. Vigene病毒产品及使用
4. 研究结果(部分)
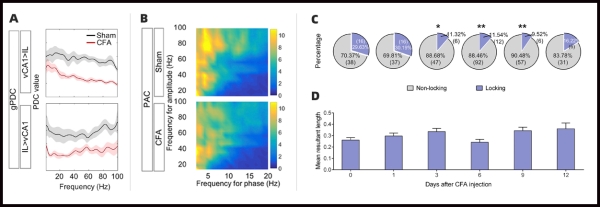
4.1 自发性疼痛降低vCA1−IL通路的功能连接性
研究人员通过自由活动大鼠在体电生理记录技术,长期检测vCA1−IL通路在整个炎症痛病程中的功能特征,发现两个脑区的电生理变化(包括功能连接度的降低、神经元放电率的下降、伤害性刺激反应时受到海马锁相的前额叶神经元比例下降等)仅在大鼠自发疼痛持续的时间段内(9天内)显著。
图1.自发痛存在期间,vCA1-IL通路功能连接性下降
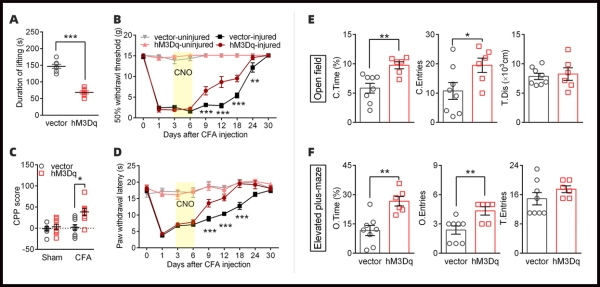
4.2 激活vCA1-IL通路可减轻自发性疼痛,加速炎症性疼痛的全面恢复
研究人员采用光/化学遗传学的技术特异性的激活该通路的投射,发现炎症痛大鼠的自发疼痛行为有了显著的减轻。并且,通过持续激活该通路,可以缩短整个炎症疼痛病程,加速诱发痛敏的恢复,避免疼痛慢性化后期负性情绪的出现。这为vCA1-IL通路通过对自发痛的调节,参与到疼痛慢性化病程提供了直接证据。
图2.化学遗传激活vCA1-IL通路缓解炎症导致的自发痛、诱发痛及焦虑样情绪
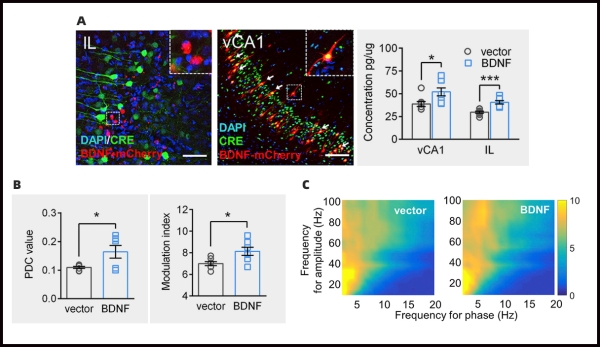
4.3 BDNF的缺乏是导致vCA1-IL通路功能紊乱的分子机制之一
炎性疼痛可以引起BDNF在两个脑区的表达含量的降低,研究人员利用维真腺相关病毒,将AAV2-retro-hSyn-Cre-GFP注射到IL中,AAV2-CAG-DIO-BDNF-mCherry-3*flag注射到vCA1中,注射6周后,发现特异性地上调腹侧海马-边缘下皮层投射的BDNF的表达,可以有效地逆转vCA1-IL通路的电生理功能的异常,并且减轻了大鼠的自发疼痛,进而加速了整个慢性炎症的恢复过程。
图3.过表达BDNF增强了vCA1-IL通路功能的连接性
文章小结
本文通过对慢性炎症痛大鼠的整个病程的行为和功能变化的观察,揭示了腹侧海马—边缘下皮层通路通过调节炎症自发痛参与到疼痛的持续过程。本项研究揭示了这一临床现象的生物学机制,发现与自发痛特异性相关的神经通路,并为慢性疼痛的基础研究与临床治疗开辟了新思路。
 当前位置:首页 > 研究领域 > 神经系统
当前位置:首页 > 研究领域 > 神经系统